
图一,WalterDandy阐述了脑实质肿瘤的切除技术(Dandy WE. The Brain.Hagerstown, MD:WF Prior Company, 1966)
国际卫生组织分类的胶质起源的1、2级胶质肿瘤被认为是低级别胶质瘤(LGGs)。低级别胶质瘤有三种:星形细胞瘤,少突神经胶质瘤,少突-星形细胞瘤。LGGs起源于其中一种或者两种胶质细胞类型,包括:星形胶质细胞或者少突胶质细胞。研究显示:肿瘤切除的程度被认为是影响总生存期、无进展生存、和肿瘤恶性转化较有力的因素之一。然而,在相应研究中出现的选择性偏倚证实了正确应用已发布的数据于实际治疗的重要性。
这些肿瘤通常发生于年青患者(20-64岁,平均年龄39岁),及时诊治的话他们可以获得长的生存期而没有并发症,尽管在放射学和病理组织学特征上,LGGs比起高级别胶质瘤侵袭性更低,但是许多患者还是因为肿瘤进展和恶性转化而死亡,因此,顺利前提下,较大化切除肿瘤可以为患者提供更好的生存质量和更长的生存期。
诊断
大约60-80%的LGGs患者表现为全身发作的癫痫症状,此外局灶性癫痫、头痛和进展性的神经功能缺失如无力、感觉丧失、失用症或失语也是较常见的症状和体征。偶然发现,或者由于外伤或者其他不相关原因进行影像学检查发现LGGs的概率较低。
评估
通常情况下,CT和MRI是诊断这类肿瘤的优选检查,这取决于一开始评估的地方,核磁共振使用钆造影剂增强前后成像的比较可以精确评估肿瘤的边界、生长程度及其对比增强剂吸收的程度。增强的信号与高级别胶质瘤的特征是一致的。
低级别胶质瘤往往在核磁上不增强(特别是2级肿瘤),然而,毛细胞性星形细胞瘤、低级别星形胶质细胞瘤往往表现为有增强瘤壁结节的囊性肿瘤。视神经胶质瘤可以扩展生长导致视神经、视交叉、视束变粗增大从而导致增强表现。与高级别胶质瘤的瘤周水肿相比,低级别肿瘤的这个特征并不典型。
功能磁共振成像对部分病人手术计划的制定很重要,它提供了有价值的信息,使术者可以辨别病变与病变毗邻的功能区。然而它替代不了术中对肿瘤周围重要功能区的脑皮层刺激图谱。此外,弥散张量成像(DTI),可以显示肿瘤周围的白质束,还可以估计肿瘤对纤维束的浸润程度。
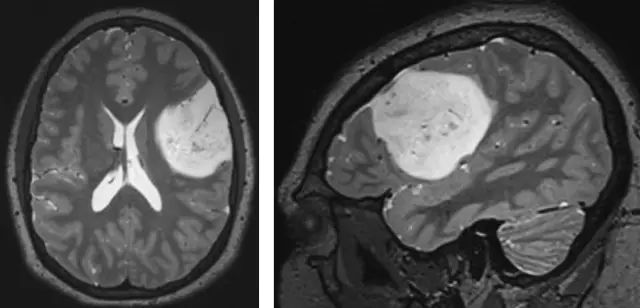
图二,传统发现肿瘤不增强很好定义了皮质低级别胶质瘤,T2像上的斑点状钙化和不均匀的表现的特点符合少突胶质瘤的诊断。
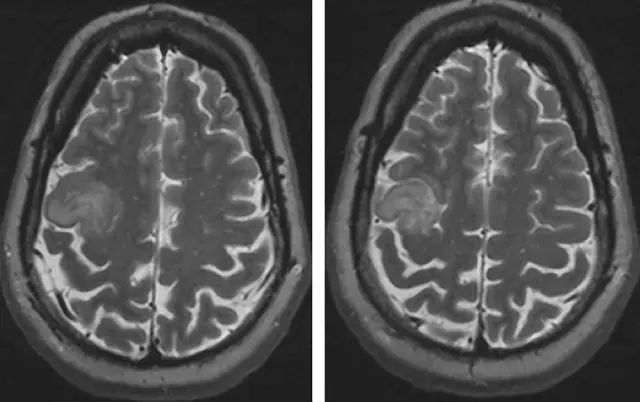
图三,位于运动皮层的一例低级别胶质瘤(上图),fMRI和DTI显示肿瘤周围传导束的损伤,肿瘤和传导束在图上截然不同(中间图像)。术中MRI可以引导肿瘤整体切除而不引起新的神经损伤(下图)。
手术适应症
切除的适应症(相比活检)包括做出可靠的组织诊断而避免取到无效的样本、控制顽固性癫痫、切除瘤细胞防止肿瘤恶性变、提高患者的生存期。
切除非功能区或者额颞较区域具有大致影像学轮廓的病变是普遍的手术适应症,特别是年轻的患者。 邻近功能区的肿瘤建议需依照肿瘤的位置和浸润程度个体化切除。
一些术者认为,为了证明显微外科手术的风险收益率,至少应该切除>80%的肿瘤,肿瘤的位置及浸润程度影响手术的效果,多发肿瘤更倾向于行肿瘤活检。
术前注意事项
低级别胶质瘤通常无周围脑组织的水肿,术前、术中及术后类固醇激素的使用存在争论,但通常被使用,围手术期强烈使用抗血管痉挛的药物。
术前进行唤醒-睡眠脑皮层刺激图谱或者标准开颅术,这需要考虑病变所涉及皮层的功能。手术前准备、开颅及其他手术方式需考虑肿瘤的语言区皮层刺激图谱和体感诱发电位图谱,这是很重要的细节。
低级别胶质瘤的切除
一些患者术后复发需要再次切除,所以手术的切除计划需要精心设计。线性切口可以更灵活的设计,并可为再次手术提供充足的血供支持。
尽管小的直切口是可取的,但是为了更完全的切除肿瘤,并通过电刺激到达肿瘤和正常皮层的界限时,一些患者还是需要较大的切口设计。更多的有关手术开颅暴露肿瘤、包括开颅方式,术中导航的使用可以确定开颅的范围。
硬膜内切除过程
低级别胶质瘤的供血血管较小,切除相对简单。术中可以使用吸引器边分离边吸除肿瘤,防止切除后的残腔出血。
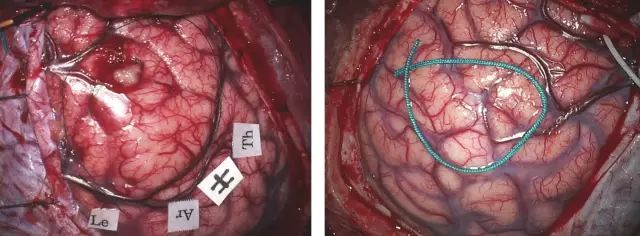
图四,硬膜弧形或者放射状剪开。暴露需充分,要显露肿瘤及周围正常皮质。看似相对正常的皮质呈带状覆盖肿瘤边界。在牵拉大脑之前(切除肿瘤减压和或释放脑脊液),我会用导航系统确定肿瘤边界,仔细的观察可以发现受浸润脑回扩大、颜色变浅和血供减少。如果有必要,刺激大脑皮层可以精确定位功能区的边界。周围大血管(动脉和静脉)要加以识别和保护。
在脑组织的移位(通常是由于肿瘤减容和释放脑脊液导致的)出现之前,我在导航引导下用一条丝线来标记肿瘤的边界。仔细的观察脑表面,可发现肿瘤波及的脑回增宽,颜色变白和血供明显减少。如有必要,皮质刺激可以精确定位功能区皮质的边界。肿瘤周围的大静脉和动脉得以识别和保留。
图五,低级别胶质瘤周围皮层可能(左)或者没有(右)发生形态学的变化。在左边的图片,右侧额前运动皮质扩大,矢状窦被挤压到后方。在右图中,额叶右后方的肿瘤(绿色丝线的范围)引起皮质形态变化要小的多。

图六,开始电凝肿瘤边界,烧灼肿瘤表面的血管。通往皮质的动静脉要加以保护。切除一块肿瘤组织进行组织学检查以确认术前诊断。
一些LGGs边缘弥散,很难与周围正常/功能区组织完全确定明确的边界。然而,LGGs的一些其它特征使其可从周围正常组织中被明确的识别出来。也就是说,一些LGGs有明确特征的,包括:灰色的、柔软的、易于被吸除等;这些有利于神经外科医生大部切除肿瘤。而其它一些肿瘤相对纤维状,有异质性,这使切除过程变得复杂,因为操作者没有可靠的方法来辨别肿瘤与瘤周正常脑组织的方法。
动态的轻柔的牵拉周围脑组织将牵拉性损伤降到较低。沿着纵裂和侧裂软膜下切除肿瘤是值得的。

图七,我喜欢在术中根据肿瘤组织的一致性和术中导航逐步切除肿瘤,如果可能的话,我也会尝试整块切除肿瘤,瘤内切除会使得导航精确度下降产生漂移。更重要的是,整块切除肿瘤提高了效率,减少了出血,使得术者保持他的切除方向,同时还沿着肿瘤周边进行切除。瘤内外同时操作会混淆肿瘤的边界。
吸引器可作为动态牵拉的导引,防止切除过程中肿瘤壁塌陷。
值得强调的是沿着白质切开和分离肿瘤的技术是重要的。双较电凝反复电灼使得肿瘤凝成假囊状。这可以导致瘤周水肿乳化从而切除肿瘤。接下来,吸引器吸除乳化的白质然后暴露下一层结构再继续电凝和切断。上述断开和电凝白质是同时进行的,换句话说,双较电凝合适的充当了肿瘤剪刀的角色,即通过双较反复电凝达到上述目的(上图,图7)。
肿瘤对双较电凝的反应是完全和大脑不同。这是指导神外医生手术的一个重要因素。一些低级别胶质瘤比正常大脑有更多的纤维,更多的呈现凝胶状。区别瘤旁的脑组织和正常大脑有挑战性。
图八,肿瘤较终被切除,产生一个很深的瘤腔,使用导航评估切除的程度。为达到满意的效果,瘤腔壁的进一步切除是必要的。切除直到瘤腔周围看到干净的白质(明亮的、闪闪发光的)。肿瘤通常显得比较晦暗,LGGs经常扩展到室管膜水平并进入脑室是肿瘤较深的部分。
术中其他方面的考虑
许多低级别胶质瘤和周围脑回的软膜关系密切,而不是深部的白质束。深部肿瘤切除过程中由于肿瘤减容导致导航精确性的下降,这会导致大脑图像漂移,从而让我们认为肿瘤减小了。在切除过程中,术者使用吸引器感知的肿瘤的质地和反馈的感觉这些重要的经验是较终决定手术切除的重要因素之一。
不幸的是,目前还没有可靠及实用的方法引导术者沿着肿瘤边界切除。肿瘤边界经常看起来感觉几乎和正常大脑组织一样,浸润到正常功能皮质和白质传导束。术者应当在手术开始就熟悉肿瘤的质地然后根据这些信息来更好的判断肿瘤模糊的边界的部分。脑室在切除深部肿瘤的边界时是一个很好的边界。
虽然术中MRI可能是有帮助的,但是我认为术中MRI低效而且不能代替外科医生的手术经验。
一些肿瘤包绕着血管(如大脑中动脉复合体),在这些区域应尽量避免使用吸引器,因为可能会导致血管损伤出现小破口而出血。术者的切除肿瘤需权衡这些重要血管的损伤的风险。目前,还没有外科手术方法可以全切LGGs。因此,处理这类肿瘤时功能的保护是首要目标。
关颅
术后注意事项
术后48小时内行MRI以评估肿瘤切除程度。一个关键、客观、细致的回顾性研究(随访)是必要的,这样可以提高外科医生的学习曲线,便于以后可以更好的切除肿瘤。
类固醇激素需要逐渐停止使用因为可能产生耐受,术后可以预防性使用抗癫痫药物(或者可以增加用量)。
优点和缺点
术者在术中根据肿瘤的质地及颜色来确保较大化切除肿瘤的经验不可低估。相比正常脑组织,术者对肿瘤使用双较和吸引器反馈的感觉是另外一个指导术者切除肿瘤的重要因素。
Contributor:Gina Monaco,MD
DOI: https://doi.org/10.18791/nsatlas.v4.ch02.6




