James T.Rutka教授曾任世界神经外科学院院长,目前是世界神外知名杂志《Journal of Neurosurgery》主编,30多年来深耕儿童神外研究,带领团队不断突破,从脑瘤分子分型、精准治疗、新药治疗、微创治疗,为全球神经外科疑难病患儿带来希望,他新近发表研究《Auger electron-emitting EGFR-targeted and non-targeted[197Hg]Hg-gold nanoparticles for treatment of glioblastoma multiforme(GBM)》(Auger电子发射型EGFR靶向与非靶向[¹⁹⁷Hg]Hg-金纳米粒用于多形性胶质母细胞瘤(GBM)治疗),以下是研究简述。
01
PART
研究背景&目标
我们报道一种用于GBM的放射纳米药物:以金纳米粒(AuNPs)为载体,整合Auger电子发射体¹⁹⁷Hg。[¹⁹⁷Hg]Hg-AuNPs分别与抗EGFR抗体帕尼单抗(panitumumab)偶联(靶向型)或保持非靶向。
研究目标:
①在体外比较帕尼单抗-[¹⁹⁷Hg]Hg-AuNPs与非靶向[¹⁹⁷Hg]Hg-AuNPs对人GBM U251-Luc细胞的细胞毒性与DNA损伤效应,并估算细胞剂量学;
②在NRG小鼠原位U251-Luc脑肿瘤模型中,通过对流增强递送(CED)给药后,比较两种纳米粒的体内生物分布,并计算肿瘤及周围正常脑组织的吸收剂量。
02
PART
研究结果
[¹⁹⁷Hg]Hg-AuNPs(粒径26.8±6.4 nm)通过在Turkevich法中引入¹⁹⁷Hg形成汞-金合金,放射化学产率为98±1%。帕尼单抗-[¹⁹⁷Hg]Hg-AuNPs对EGFR阳性U251-Luc细胞亲和力强(KD=1.8×10⁻⁹mol/L)。其细胞结合力为非靶向[¹⁹⁷Hg]Hg-AuNPs的15倍,内化及核摄取分别提高12倍和18倍。帕尼单抗-[¹⁹⁷Hg]Hg-AuNPs诱导的DNA双链断裂(DSB)比非靶向组高84倍,克隆形成抑制效应高9倍。与非放射性帕尼单抗-AuNPs相比,靶向放射性纳米粒细胞毒性高2倍(P=0.04),比帕尼单抗单药高5倍(P=0.01)。
体外细胞核吸收剂量:帕尼单抗-[¹⁹⁷Hg]Hg-AuNPs 8.8±2.9 Gy,非靶向组0.6±0.1 Gy。SPECT/CT显示,CED给药后7 d内,两种[¹⁹⁷Hg]Hg-AuNPs均在脑内注射部位高浓度滞留。肿瘤侧半球摄取:帕尼单抗-[¹⁹⁷Hg]Hg-AuNPs 484.5%ID/g,分别为健侧半球172倍、小脑579倍;非靶向组423.9%ID/g,分别为健侧85倍、小脑64倍。正常组织摄取大多<1%ID/g,仅肾脏9–20%ID/g、脾脏3.5–6.6%ID/g、肝脏0.6–3.3%ID/g较高。剂量学显示,1.0 MBq帕尼单抗-[¹⁹⁷Hg]Hg-AuNPs使58%肿瘤区域剂量>190 Gy,而非靶向组仅0.6%;但两组均有95%肿瘤区域剂量>50 Gy。距肿瘤边缘1–3 mm处剂量迅速降至1.7 Gy(靶向组)和3.3 Gy(非靶向组)。
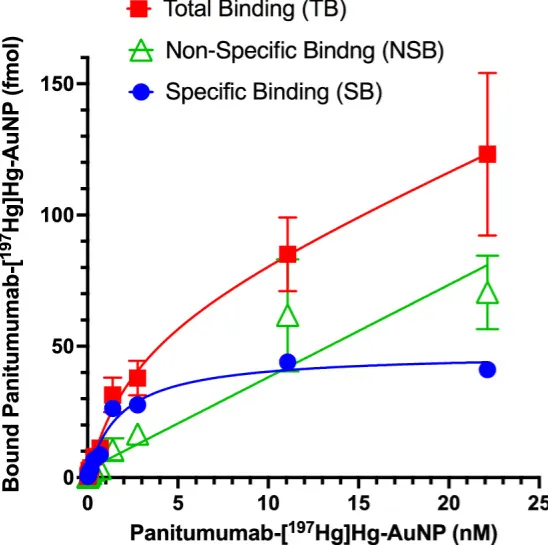
图1在无(总结合,TB)或存在过量帕尼单抗(非特异结合,NSB)的条件下,测定递增浓度帕尼单抗-[¹⁹⁷Hg]Hg-AuNP与U251-Luc细胞的结合。特异结合(SB)=TB-NSB。将SB曲线按单一位点受体结合模型拟合,所得KD=1.8×10⁻⁹mol/L,Bmax=47.44 fmol,换算为每个细胞约1.1×10⁵个EGFR。
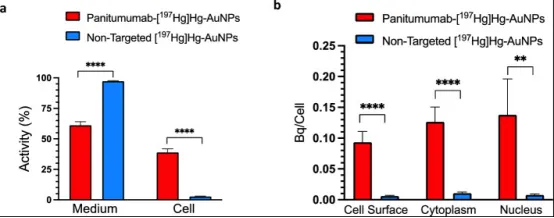
图2.a培养基残留活性及细胞结合活性百分比;b U251-Luc人GBM细胞与帕尼单抗-[¹⁹⁷Hg]Hg-AuNP或非靶向[¹⁹⁷Hg]Hg-AuNP孵育19 h(37°C/5%CO₂)后,膜表面、胞质及核内的细胞结合活性(Bq/细胞)。数据为均值±SD(n=4),*P=0.0043,****P<0.0001。
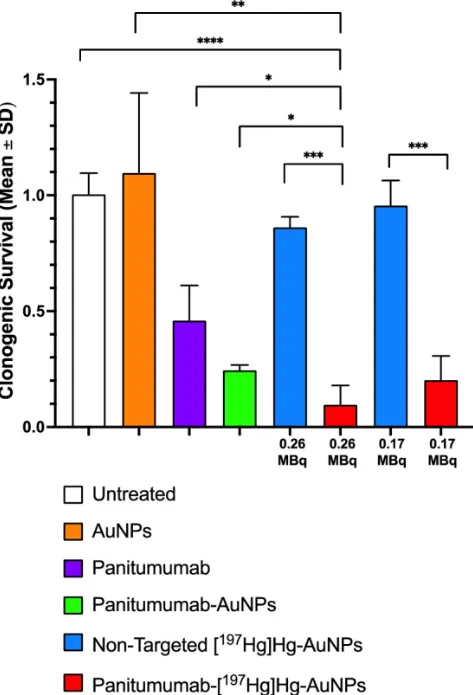
图3 U251-Luc细胞分别用0.17或0.26 MBq帕尼单抗-[¹⁹⁷Hg]Hg-AuNP、非靶向[¹⁹⁷Hg]Hg-AuNP,或等量帕尼单抗、帕尼单抗-AuNP、非靶向AuNP及未处理对照处理24 h(37°C/5%CO₂),随后接种培养8 d的集落存活实验。数据为均值±SD(n=3),*P<0.05,**P<0.01,***P<0.001,****P<0.0001。
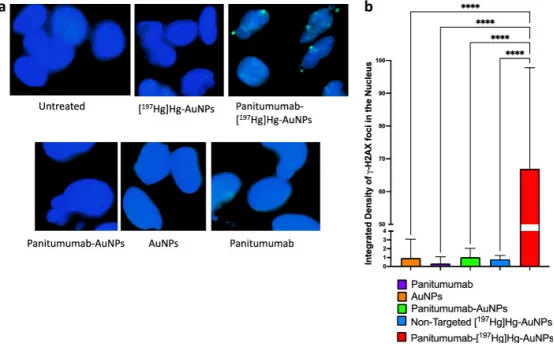
图4 U251-Luc细胞经γ-H2AX免疫荧光检测核内DNA双链断裂。a未处理或分别用非靶向[¹⁹⁷Hg]Hg-AuNP、帕尼单抗-[¹⁹⁷Hg]Hg-AuNP、非放射性帕尼单抗-AuNP、AuNP或帕尼单抗处理24 h(37°C/5%CO₂)后的细胞核图像;γ-H2AX焦点呈亮绿色,核用DAPI蓝色复染。b各处理组核内γ-H2AX焦点积分密度定量。数据为均值±SD(n=5),****P<0.0001。
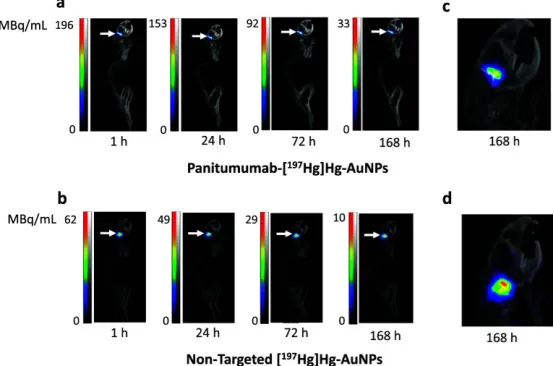
图5右侧脑内携带原位U251-Luc人GBM肿瘤的NRG小鼠经对流增强递送(CED)给予:a帕尼单抗-[¹⁹⁷Hg]Hg-AuNP或b非靶向[¹⁹⁷Hg]Hg-AuNP(箭头所示)后,至168 h的SPECT/CT影像。每时间点给出强度标尺(MBq/mL)。c、d脑部放大视图显示两种纳米粒在脑内注射部位的局部扩散差异。
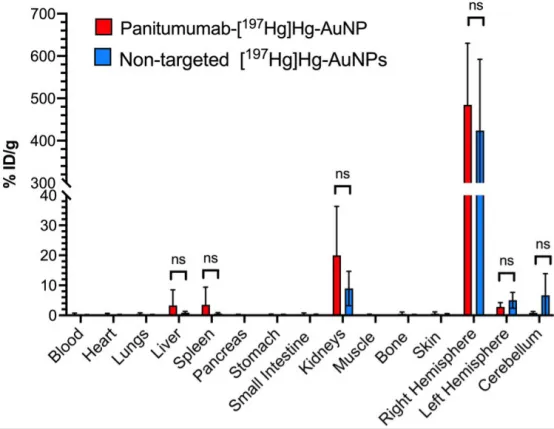
图6 168 h p.i.时帕尼单抗-[¹⁹⁷Hg]Hg-AuNP与非靶向[¹⁹⁷Hg]Hg-AuNP的生物分布。肿瘤未能从脑组织中分离,计入右半球组织;左半球及小脑无肿瘤。数据为均值±SD(n=4–5)。此时点两种纳米粒生物分布无显着差异(P>0.05)。
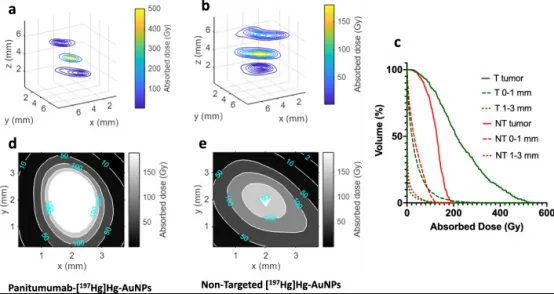
图7 NRG小鼠脑内肿瘤经CED给予帕尼单抗-[¹⁹⁷Hg]Hg-AuNP(a、d)或非靶向[¹⁹⁷Hg]Hg-AuNP(b、e)后,围绕肿瘤内注射部位的吸收剂量分布。a、b为z=4 mm肿瘤中心层面及z=2或6 mm(距肿瘤边缘1 mm)处的三维等剂量轮廓x–y切片;d、e为肿瘤最大吸收剂量层面的二维等剂量轮廓。c为肿瘤及距肿瘤边缘0–1 mm与1–3 mm脑区的剂量-体积直方图(DVH),分别对应帕尼单抗-[¹⁹⁷Hg]Hg-AuNP(T)与非靶向[¹⁹⁷Hg]Hg-AuNP(NT)。
03
PART
研究结论
含Auger电子发射体¹⁹⁷Hg并经CED给药的放射纳米药物是治疗GBM的有前景策略。帕尼单抗-[¹⁹⁷Hg]Hg-AuNPs因EGFR介导的结合、内化及核输入而增强GBM细胞体外毒性,尤具吸引力。
04
PART
关于作者

国际儿童神外大咖James T.Rutka教授
教授是世界神经外科联合会(WFNS)执行委员会&顾问委员会成员之一,发表超过500多篇的文章,在临床上的研究方向以颅内肿瘤为主,对胶质瘤、纤维瘤、颅咽管瘤、室管膜瘤具有多年的临床经验,擅长清醒开颅术、显微手术和被广泛用于治疗恶性脑瘤和癫痫的国际前沿技术激光间质热疗(LITT)技术经验,对于儿童胶质瘤,尤其是高级别胶质瘤开展多项临床试验,其所在的医院加拿大SickKids是国际知名的儿童医院之一。




