在神经肿瘤的临床诊疗中,弥漫性星形细胞瘤是一类兼具复杂性与争议性的病变。当患者手持写有 "弥漫性星形细胞瘤" 的影像报告或病理诊断时,往往会被一连串的疑问笼罩:这究竟是良性肿瘤还是恶性肿瘤?影像学检查中的异常信号意味着什么?病理报告里的分级数字代表何种预后?这些困惑的背后,实则串联着中枢神经系统肿瘤诊断的核心逻辑 —— 从宏观影像特征到微观分子病理,从组织学分级标准到临床诊疗策略。我们将以临床实践为导向,结合 2021 年世界卫生组织(WHO)中枢神经系统肿瘤分类最新标准,系统解析弥漫性星形细胞瘤的生物学特性、影像学表现、病理分级体系及临床诊疗要点,为医患双方建立清晰的认知框架。

一、弥漫性星形细胞瘤良性恶性之辨:生物学行为定位
弥漫性星形细胞瘤(Diffuse Astrocytoma)起源于大脑星形胶质细胞,是中枢神经系统常见的原发性胶质瘤之一,约占所有星形细胞肿瘤的 15%-20%。与边界清晰、生长缓慢的毛细胞型星形细胞瘤不同,弥漫性星形细胞瘤具有独特的生物学行为:其肿瘤细胞呈浸润性生长,沿神经纤维束、血管周围间隙及软脑膜广泛扩散,即使在低级别阶段也可能累及重要脑功能区,这一特性直接决定了其临床处理的复杂性。
(一)良恶性的传统认知与现代修正
在传统病理分级体系中,弥漫性星形细胞瘤被归为 WHOⅡ 级,属于 "低级别胶质瘤",而间变性星形细胞瘤(WHOⅢ 级)则被视为恶性阶段。但这种二元划分在分子病理时代面临挑战:2016 年 WHO 中枢神经系统肿瘤分类引入整合诊断概念,强调结合 IDH 突变状态、1p/19q 共缺失等分子特征进行分类。最新的 2021 版 WHO 分类进一步明确,弥漫性星形细胞瘤特指具有 IDH 突变和 ATRX/TP53 突变的浸润性星形细胞肿瘤,而 IDH 野生型的同类病变需重新评估,可能归为更高恶性潜能的肿瘤类型。
(二)恶性转化的分子预警信号
约 40%-60% 的弥漫性星形细胞瘤(WHOⅡ 级)会在病程中发生恶性转化,进展为间变性星形细胞瘤(WHOⅢ 级)或胶质母细胞瘤(WHOⅣ 级),中位转化时间约为 5-10 年。分子层面,IDH1/2 突变导致的 2 - 羟基戊二酸(2-HG)积累,可诱导表观遗传改变和细胞分化障碍,成为恶性转化的起始事件;而 TP53 基因突变(约 80% 病例存在)会破坏 DNA 损伤修复机制,加速基因组不稳定性;ATRX 蛋白失活则与端粒异常延长相关,促进肿瘤细胞永生化。临床研究显示,同时存在 CDKN2A/B 纯合缺失的患者,恶性转化风险较单一突变者增加 3 倍。
(三)临床表现的良恶性提示
尽管组织学分级是判断恶性程度的核心依据,临床表现仍可提供重要线索。良性倾向的弥漫性星形细胞瘤患者常以癫痫发作(占 60%-70%)或慢性头痛起病,神经功能缺损症状进展缓慢;而恶性转化时,患者可能出现急性颅内压增高(如呕吐、视乳头水肿)、局灶性神经功能障碍快速加重(如肌力进行性下降、语言功能衰退),部分病例可伴发认知功能恶化,其 MMSE 评分较确诊时平均下降 15-20 分。
二、弥漫性星形细胞瘤影像学特征:从结构异常到分子表型的影像映射
影像学检查是弥漫性星形细胞瘤诊断的首要环节,MRI 凭借多序列成像优势,可清晰显示肿瘤的解剖定位、浸润范围及生物学特性。典型病变常位于大脑半球白质区,以额叶、颞叶多见,少数可累及岛叶、胼胝体等深部结构。
(一)基础序列的特征性表现

(二)增强扫描的临床意义
增强扫描在弥漫性星形细胞瘤评估中具有双重价值:一方面,WHOⅡ 级肿瘤通常无明显强化(强化率 < 10%),若出现局灶性强化(强化范围 < 肿瘤体积 25%),需警惕早期恶性转化;另一方面,强化模式可辅助鉴别诊断 —— 与血管母细胞瘤的结节样强化、胶质母细胞瘤的花环状强化不同,弥漫性星形细胞瘤的异常强化多表现为斑点状或线样血管影,对应病理上的微血管增生(非真性血管内皮增殖)。
(三)功能成像的分子表型预测
MRS(磁共振波谱):N - 乙酰天门冬氨酸(NAA)降低提示神经元损伤,胆碱(Cho)升高反映细胞膜代谢活跃,Cho/Cr 比值 > 2.5 常提示恶性转化倾向;IDH 突变型肿瘤可见特征性 2-HG 峰(3.56ppm 处反向双峰)。
PWI(灌注成像):良性病变表现为低灌注(rCBV<1.5),恶性转化时 rCBV 显著升高(2.0-3.5),与血管内皮生长因子(VEGF)表达增加导致的新生血管形成相关。
DTI(弥散张量成像):肿瘤浸润区 FA 值降低、ADC 值升高,纤维束成像可显示神经纤维束受压推移而非破坏,这一特征对手术方案设计具有重要指导意义。

三、弥漫性星形细胞瘤分级体系:从组织学特征到分子整合诊断的演进
弥漫性星形细胞瘤的分级是决定治疗策略和预后评估的关键。2021 年 WHO 分类建立了 "组织学 - 分子" 整合分级体系,强调 IDH 突变状态作为分级的核心参数,同时结合细胞异型性、核分裂象、血管增生及坏死等组织学特征(表 1)。
表 1 弥漫性星形细胞瘤的 WHO 分级标准(2021 版)
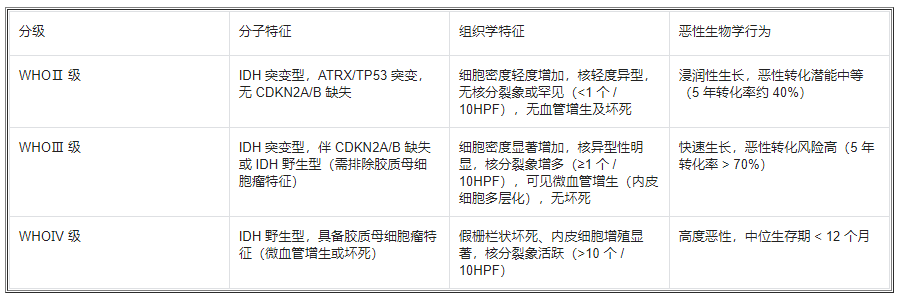
(一)关键组织学指标的病理判读
细胞异型性:良性病变的肿瘤细胞形态接近正常星形细胞,可见肥胖细胞型或纤维型分化;恶性病变则表现为细胞核深染、大小不一,出现多核巨细胞或怪异核型。
核分裂象:需在高倍视野(HPF,×400)下计数,WHOⅡ 级肿瘤核分裂象罕见(<1 个 / 10HPF),而 WHOⅢ 级≥1 个 / 10HPF,且常伴随 Ki-67 增殖指数升高(Ⅱ 级 < 5%,Ⅲ 级 5%-20%)。
血管增生:良性病变可见反应性血管增生(血管壁均匀增厚),恶性病变则表现为真性微血管增殖(血管内皮细胞多层化、形成肾小球样结构),与 VEGF、HIF-1α 通路激活密切相关。
(二)分子病理检测的临床必需性
分子检测已从科研工具转化为临床诊断的核心环节:
IDH1/2 突变:约 80%-90% 的弥漫性星形细胞瘤存在 IDH1 R132H 突变,其余为 IDH2 R172 突变,突变状态决定肿瘤的代谢表型和治疗反应。
ATRX/TP53 突变:ATRX 蛋白缺失提示端粒维持机制异常,TP53 突变率与肿瘤侵袭性正相关,两者联合检测可辅助鉴别诊断(如少突胶质细胞瘤通常无 ATRX/TP53 突变)。
CDKN2A/B 缺失:位于 9p21.3 的 CDKN2A/B 基因纯合缺失,是恶性转化的关键驱动事件,缺失患者的中位无进展生存期较未缺失者缩短 40%。
四、弥漫性星形细胞瘤病理组织学:从细胞形态到分子网络的病理画卷
弥漫性星形细胞瘤的病理诊断需在光镜下观察细胞形态、生长方式及微环境特征,同时结合免疫组化和分子检测构建完整的病理图谱。
(一)经典组织学亚型
纤维型星形细胞瘤:最常见(占 60%-70%),肿瘤细胞呈长梭形,胞质少,突起丰富交织成网状,间质可见微囊变,GFAP 染色阳性。
肥胖细胞型星形细胞瘤:肿瘤细胞胞质丰富嗜酸性,呈 "饱满" 的多边形,核偏位,常伴毛细血管增生,此型恶性转化风险较高(5 年转化率达 60%)。
原浆型星形细胞瘤:少见,细胞密度低,胞质少而透明,间质微囊变明显,需与少突胶质细胞瘤鉴别(后者存在 IDH 突变及 1p/19q 共缺失)。
(二)免疫组化标志物的诊断价值
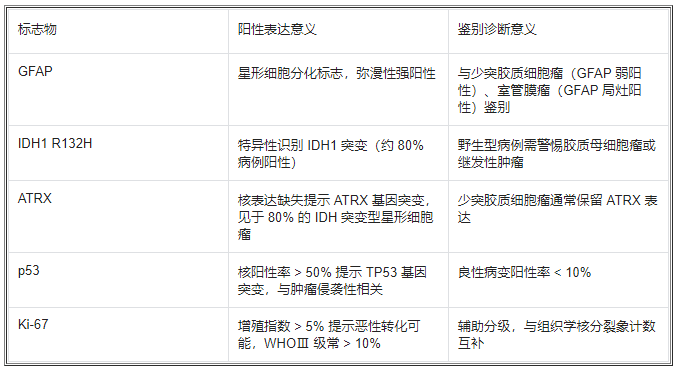
(三)微环境特征与肿瘤进展
肿瘤微环境在弥漫性星形细胞瘤的生长和转化中扮演重要角色:
免疫细胞浸润:CD68 + 巨噬细胞在肿瘤边缘富集,通过分泌 IL-6、TGF-β 促进肿瘤细胞侵袭;FOXP3 + 调节性 T 细胞增多与免疫抑制微环境相关,提示预后不良。
细胞外基质:波形蛋白(Vimentin)阳性的间质纤维增生,形成肿瘤细胞迁移的 "支架";层粘连蛋白(Laminin)表达增加与血管基底膜破坏相关,促进肿瘤细胞向血管周围间隙扩散。
代谢特征:IDH 突变导致的 2-HG 积累,可抑制组蛋白去甲基化酶,引发 DNA 甲基化异常,形成 "表观遗传沉默" 状态,阻碍细胞分化并促进干性维持。
五、弥漫性星形细胞瘤相关问题

(一)弥漫性星形细胞瘤与胶质母细胞瘤如何鉴别?
核心区别在于分子特征和组织学恶性征象:胶质母细胞瘤多为 IDH 野生型,具有特征性的假栅栏状坏死和内皮细胞增殖,而弥漫性星形细胞瘤(即使进展为 WHOⅢ 级)若为 IDH 突变型,通常无坏死,且保留 ATRX/TP53 突变特征。影像学上,胶质母细胞瘤常伴明显占位效应、瘤周水肿及花环状强化,而弥漫性星形细胞瘤强化不明显或仅局灶强化。
(二)低级别弥漫性星形细胞瘤是否需要立即手术?
需结合肿瘤位置、生长速度及症状综合判断:对于位于非功能区、体积较小(直径 < 3cm)、无症状的 WHOⅡ 级肿瘤,可选择密切观察(每 3-6 个月 MRI 随访);若肿瘤位于功能区(如语言区、运动皮层),或出现癫痫药物控制不佳、神经功能进行性缺损,应优先考虑手术切除,争取最大安全切除(EOR≥80% 可延长无进展生存期)。
(三)分子靶向治疗在弥漫性星形细胞瘤中有哪些进展?
针对 IDH 突变的口服抑制剂(如 ivosidenib、enasidenib)已进入临床试验,可降低 2-HG 水平并诱导肿瘤细胞分化,初步数据显示客观缓解率约 30%-40%;针对 TP53 突变的基因治疗(如 ONCOS-102 溶瘤病毒)及表观遗传药物(如地西他滨)也在探索中。此外,TTFields(肿瘤治疗电场)在 IDH 野生型高级别星形细胞瘤中的应用证据逐步积累,2023 年《神经肿瘤学》报道其联合放化疗可延长中位生存期 3.2 个月。
(四)弥漫性星形细胞瘤患者的预后影响因素有哪些?
独立预后因素包括:①分子特征(IDH 野生型、CDKN2A/B 缺失预后差);②手术切除程度(全切患者 5 年生存率 60%-70%,次全切者 40%-50%);③病理分级(WHOⅢ 级中位生存期 5-7 年,Ⅱ 级 8-10 年);④年龄(>40 岁患者预后显著差于年轻患者);⑤术后治疗方案(放疗联合替莫唑胺可降低恶性转化风险 25%)。
(五)儿童弥漫性星形细胞瘤有哪些特点?
儿童病例约占全部弥漫性星形细胞瘤的 15%-20%,以学龄期儿童多见,好发于下丘脑、视路及脑干等中线区域。与成人不同,儿童病例 IDH 突变率低(<10%),多伴 BRAF 基因融合(如 KIF5B-BRAF),组织学上可见更多的微囊变和嗜酸性颗粒小体,恶性转化速度较成人缓慢,但因常累及重要结构,手术全切率低,需依赖放化疗综合治疗。
结语
弥漫性星形细胞瘤的诊疗历程,折射出中枢神经系统肿瘤从形态学诊断到分子精准医疗的跨越。当临床医生在显微镜下观察到 IDH 突变型肿瘤细胞的独特形态,在 MRI 胶片上解读异常信号背后的分子密码,本质上是在破译肿瘤细胞与宿主之间的 "战争密码"。对于患者而言,理解这种疾病并非止步于 "良性或恶性" 的简单判断,而是需要建立包含影像特征、病理分级、分子状态的多维认知 —— 这不仅是医学知识的科普,更是赋予患者参与诊疗决策的 "密钥"。随着精准医疗时代的深入,弥漫性星形细胞瘤的治疗将从单一的手术切除转向手术 - 放疗 - 分子靶向的整合干预,而早期识别恶性转化信号、动态评估分子特征演变,将成为改善患者预后的关键。在这场与神经胶质瘤的持久战中,科学认知的每一次突破,都在为患者点亮更长的生命之光。




