小儿低级别胶质瘤(PLGG)是儿童时期较为常见的神经中枢系统肿瘤,占儿童和青少年原发性脑肿瘤的30-50%。其治疗策略主要是尽可能的控制肿瘤,同时减少不可逆的功能损伤。
BRAF V600突变存在于15-20%的PLGG中,且患有BRAF V600E突变的儿童胶质瘤在目前的放化疗策略下预后较差,只有不到30%的患者使用标准疗法(包括放疗和化疗)实现肿瘤控制。
BRAF突变已被确定为多种实体瘤中肿瘤生长的驱动因素,并且通常治疗选择有限。
那么,针对BRAF V600突变胶质瘤的治疗之路该往哪里走呢?
在第18届儿童神经肿瘤学国际研讨会(ISPNO)上,加拿大多伦多大学儿童医院(Sick Kids)脑瘤研究中心主席、INC世界神经外科顾问团(WANG)成员James T.Rutka教授曾发表“靶向BRAF抑制治疗BRAF V600E儿童胶质瘤的疗效”研究成果,为后续BRAF V600突变胶质瘤的治疗及预后提供参考。

BRAF V600E突变:肿瘤的“始作俑者”
BRAF V600E突变,一个乍一听有些绕口的名称,它究竟是什么呢?简单来说,它就像肿瘤新安装的“加速器”,能够促进肿瘤细胞的增殖、生长和分化,从而推动肿瘤进展,是个不折不扣的“坏蛋”。
BRAF基因位于7q34,是RAF家族的成员之一,RAF家族还包括ARAF和RAFl(CRAF)基因,是RAS/RAF/MEK/ERK/MAPK通路重要的转导因子,参与调控细胞内多种生物学事件,如细胞生长、分化和凋亡等。
在实体肿瘤中,BRAF突变的发生率较高,V600E替代约占突变的80%。BRAF-V600E突变可导致MAPK信号通路的持续性激活,引起肿瘤细胞分化增殖、代谢、生长的改变,这意味着,BRAF V600E是一个突变癌基因,也是多种肿瘤的“始作俑者”。
BRAF突变可发生在多种胶质瘤中,包括约2/3的多形性黄色星形细胞瘤、20%的节细胞胶质瘤以及10%的毛细胞型星形细胞瘤。偶尔弥漫性胶质瘤可能也有BRAF V600E突变。
BRAF V600E也见于大多数的室管膜下巨细胞星形细胞瘤,以及约50%的上皮样胶质母细胞瘤。尽管BRAF基因突变在胶质瘤中不具有预后意义,但其与特定组织部位的关系对胶质瘤的分类十分重要。
在儿童低级别胶质瘤(PLGG)中,BRAF V600E会增加治疗后复发的风险,且存活率非常差,也有更高的恶性转化倾向,特别是合并有CDKN2A缺失时。
靶向抑制:INC Rutka教授研究成果
BRAF V600E突变主要包括三种检测方式:免疫组化Sanger测序、焦磷酸测序、二代测序。
研究表明,在上皮样胶质母细胞瘤、多形性黄色瘤型星形细胞瘤等肿瘤中BRAF V600E突变与IHC结果呈1:1对应关系。IHC法检测BRAF V600E的敏感度和特异性为94%。建议先用IHC检测,若结果为阴性患者,进一步行基因检测。
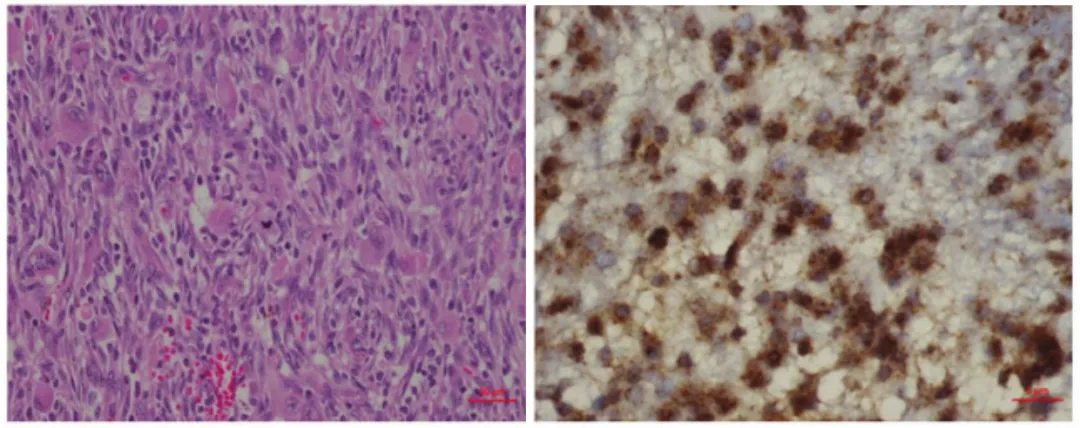
图1:BRAF V600E在胶质母细胞瘤中IHC染色示例
在BRAF V600E突变的PLGG中,只有不到30%的患者使用标准疗法(包括放疗和化疗)能够实现肿瘤控制,这表明肿瘤的临床生物学组不同。BRAF V600E是靶向治疗的标志物,BRAF基因突变患者可从靶向药物中获益。
这些数据表明,对于BRAF V600E突变的PLGG而言,尤其是5年生存率仅10%的儿童高级胶质瘤(PHGG),亟需一种新的治疗方法。
为了满足这一迫切需要,Rutka教授及其研究团队收集了来自多个国家的29个中心的BRAF V600E突变胶质瘤患者的临床、影像学、分子和预后信息。目的是研究靶向BRAF抑制在这些肿瘤中的作用。
作为当时规模最大的一组BRAF V600E PLGG患者接受BRAF抑制治疗,Rutka教授的研究结果为BRAF抑制对这一高危人群的影响提供了新的见解。
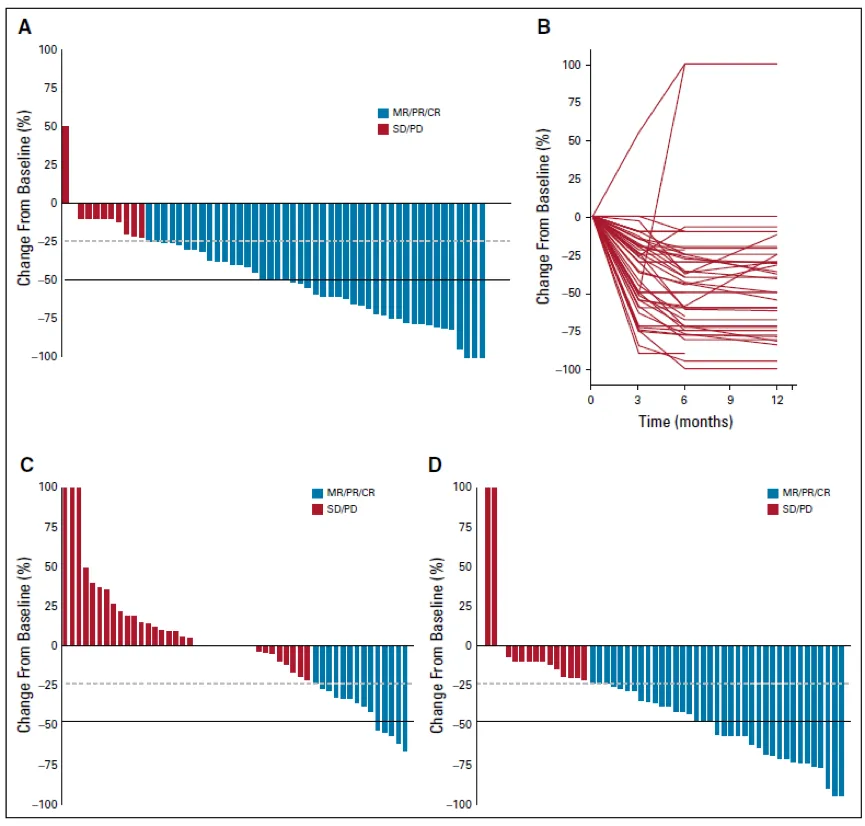
Rutka教授研究发现
Rutka教授的数据显示,使用这种靶向治疗方法,BRAF V600E突变的PLGG的初始反应和持续的疾病控制效果较好。如果BRAF抑制中断,这种效应可能会消失,并且BRAF V600E突变PHGG的抑制效果较差。
尽管Rutka教授队列中的大多数患者是用BRAF抑制治疗的复发性疾病,但是BRAF V600E突变的PLGG对BRAF抑制的反应是显著的。在80%的PLGG中观察到了客观缓解,超过半数的PLGG显示肿瘤大小减小≥50%。
值得注意的是,这些反应通常在3个月内达到,然而,BRAF抑制在少数肿瘤中带来了完全缓解。
由于BRAF抑制目前只用于复发性肿瘤,Rutka教授的数据表明,早期应用BRAF抑制治疗有可能预防PLGG患者的发病率和后遗症。研究中已经报道了视觉状态、癫痫控制和其他神经功能紊乱的改善,这些临床改善在大多数用常规放化疗治疗的PLGG中是不常见的,因此,在BRAF抑制的前瞻性试验中,这些改善应该是更好的特征。
研究中,67例患者接受BRAF抑制治疗长达5.6年,其中56例PLGG,11例PHGG。发现PLGG的有效率达到80%,而常规化疗的有效率为28%,86%的肿瘤在接受治疗时可持续5年,停止BRAF抑制后,76.5%(13/17)的PLGG患者出现快速进展(中位数为2.3个月)。
然而,在BRAF抑制再次激发后,90%的患者获得了客观反应。传统治疗中预后差的因素,如CDKN2A的纯合子缺失,与BRAF抑制无反应无关。相比之下,只有36%的PHGG患者对BRAF抑制有反应。
在PLGG中,BRAF抑制与化疗的反应分别转化为49.6%(95%CI,35.3%-69.5%)和29.8%(95%CI,20%-44.4%)的3年无进展生存率(P=0.02)。
INC国际神外专家团成员之二:Rutka教授&巴教授

INC加拿大Rutka教授
世界神经外科学院院长(2011-2014)
美洲神经外科学院院长(2012)
美洲神经外科医师协会主席(2010-2011)
国际神经外科专业知名杂志《Journal of Neurosurgery》主编(2013年至今)
多伦多大学外科学系教授、系主任(1999年至今)
多伦多大学儿童病院、亚瑟和索尼亚拉巴特脑瘤研究中心主任(1998年至今)
加拿大勋章(Order of Canada,2016年)
“国际微笑勋章”(International Order of Smile)(2006年)
关于小儿胶质瘤复发了怎么办?还能手术吗?有什么前沿的综合治疗方案?Rutka教授在接受INC独家专访时这样回答:
综合来说,胶质瘤可分为两大类,一类是良性或低度胶质瘤;另一种是儿童恶性或混合性胶质瘤,典型的低级别胶质瘤几乎没有例外,应视为是神经外科范畴的疾病。因此,有必要进行手术来治疗这些孩子,使他们处于不复发状态。
我们提倡对复发性低级别胶质瘤的儿童进行手术,治疗难度较大的肿瘤(包括脑干肿瘤、丘脑肿瘤或是视交叉部位的肿瘤),我们知道可以通过手术治疗这些孩子。
另一方面,患有高级别胶质瘤的儿童,这些儿童经常需要考虑进行实验性治疗,我们认为可以用新的治疗方案、化疗方案来治疗他们,有时用调强放疗合并干细胞移植,有时使用伽玛刀放射,在某些情况下使用质子疗法治疗,这些方法在治疗胶质瘤儿童时能获得更好的结果。
此外,作为INC国际神经外科专家团成员之一,INC国际神经外科医生集团旗下世界神经外科顾问团(WANG)成员、世界神经外科联合会(WFNS)教育与技术委员会前主席巴特朗菲教授擅长大脑半球病变、脑干病变、脑血管疾病、脑内深层区胶质瘤、颅颈交界处的病变等的肿瘤切除术、神经吻合术以及各种椎管内肿瘤等。对世界神经外科学科做出重大贡献,尤其在脑干胶质瘤的治疗上有众多成功案例。
巴教授在国内学术会议上分享自己的脑干手术技巧——延髓手术入路

德国Helmut Bertalanffy教授
世界神经外科联合会(WFNS)教育与技术委员会前主席
世界神经外科联合会(WFNS)提名委员会前主席
欧洲神经外科知名杂志《Neurosurgical Review》主编,2004-2016年
INC旗下世界神经外科顾问团(WANG)成员
INC国际神外专家团:PLGG案例合集
案例一:
巨大局灶性中脑胶质瘤
Rutka教授安全切除
病史回顾:患儿Luke在幼儿时期曾因身体出现咖啡色斑、病变处疼痛等症状就医,确诊Ⅰ型神经纤维瘤病后持续接受药物治疗,病情表现稳定。然而,13岁时Luke出现头痛、呕吐症状,复查结果显示脑干病变致使顶盖和第四脑室受累。
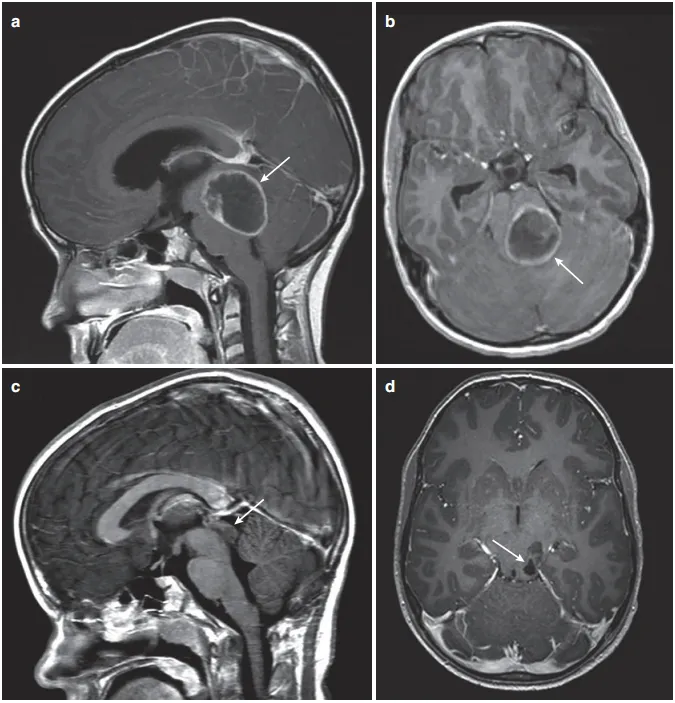
图2:(a)矢状位增强T1 MRI显示巨大后颅窝囊性病变,肿瘤中心于顶盖区(箭头)。(b)增强MRI显示顶盖和第四脑室受累程度(箭头)。(c)后颅窝开颅、肿瘤囊肿引流、囊肿囊被清除后,在MRI增强(箭头)上仅能看到小的顶盖变形。(d)术后增强MRI显示肿瘤起源于顶骨区,无占位效应(箭头)。
手术治疗:Rutka教授在详细了解Luke的病情和相关资料后表示:他可以为孩子做手术,并且能安全切除大部分肿瘤,根据术后情况决定是否辅以化疗和具体治疗方案,但暂时不建议放疗。
在得到Luke父母的肯定答复后,Rutka教授及其团队很快为患儿行切除手术。颞部开颅经左侧颞中回入路至病灶处。术中神经导航用于确定肿瘤的边界,用超声刀剥除病变。
术后情况:术后2周,患儿出现新的神经功能障碍,但只出现了一过性记忆障碍且较快恢复,术后生长和智力发育正常。由于肿瘤仍有残余,Rutka教授与团队多次内部讨论,考虑到患儿的年龄、肿瘤残余情况、既往病史等因素,为Luke制定了专属化疗方案。
事实证明,患儿对此方案耐受情况良好。后续资料显示其在随访期间继续接受化疗,但Luke已无需进一步的手术治疗,这让他的家人非常高兴。
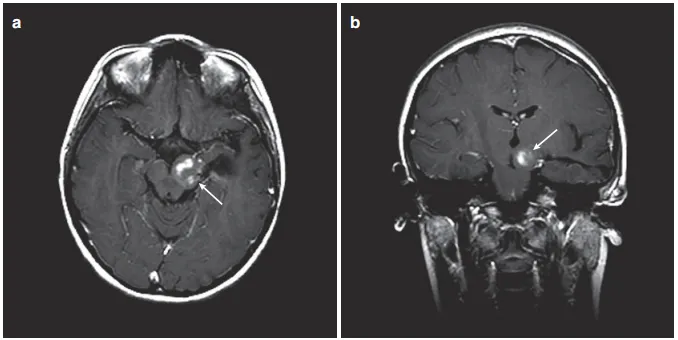
图3:患儿术后MRI,(a)轴位增强MRI显示肿瘤少量残留在左侧被盖。(b)冠状MRI对比显示从颞中回至中脑肿瘤的少量残余肿瘤。
案例二:
7岁男孩小脑-脑干胶质瘤
巴教授全切术后2年半无复发
病史回顾:2020年末,6岁的辰辰(化名)在一场小小的交通事故后总是抱怨头晕,核磁共振结果显示“小脑占位”,右侧小脑半球见40mm*37mm大小异常信号,邻近四脑室受压变窄,脑干受压,中线结构局部左移。医生给出诊断,考虑可能是低级别的星形细胞瘤。
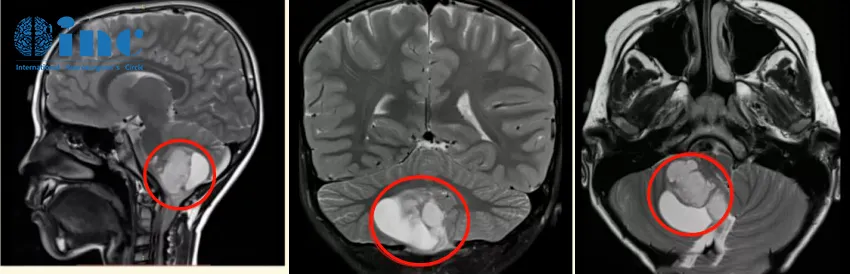
手术治疗:巴教授在详细分析辰辰的病情后表示,MR显示非常典型的小脑良性肿瘤,常见的是毛细胞性星形细胞瘤。患儿需要手术。完全切除肿瘤后,这个患儿几乎可以达到从肿瘤中康复。切除率必须达到100%,我将尽一切努力实现这一重要目标。
手术正中枕下开颅术+显微镜下肿瘤全切术,手术顺利,术中无并发症。
术后情况:患者在术中神经电生理检测护航下,于显微镜下全切肿瘤,术后MR复查确认了肿瘤全部切除,无残余,肿瘤囊肿部分也予以“开窗”、囊壁切除,双极电凝彻底烧灼基底,保护周边正常脑组织,脑干得到充分减压,对中脑的挤压/移位压力明显减少,小脑组织大部分复位。
术后当晚,拔除气管插管,无相关并发症,术后第二天,CT扫描显示术后表现正常,无出血、水肿等并发症。此后,被转入普通病房,开始了康复治疗,后逐渐恢复了活动力。术后第三天,可下床搀扶行走。
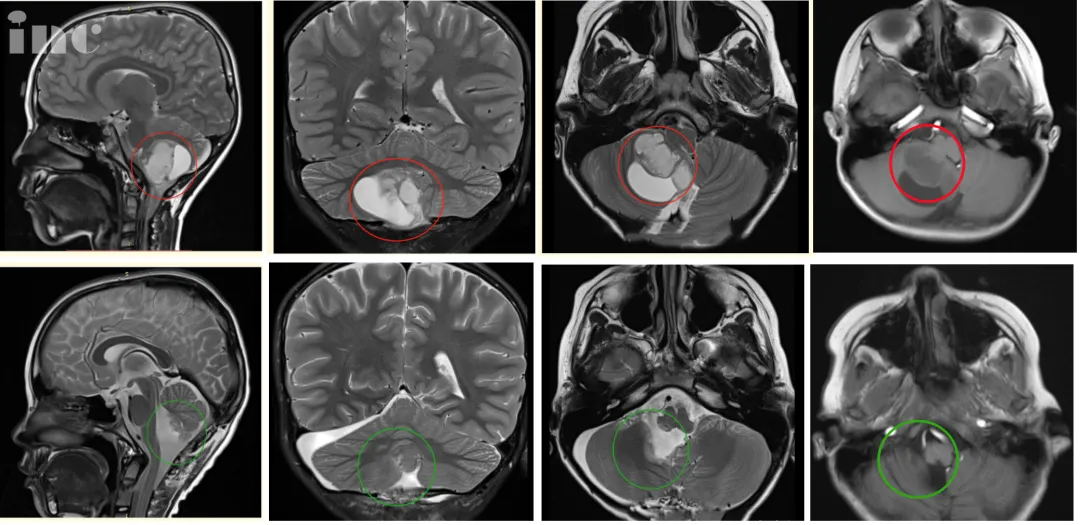
图4:术前术后影像对比。术后MR复查显示肿瘤全部切除,无残余,脑干得到充分减压,对中脑的挤压/移位压力明显减少,小脑复位。




