一直以来,患有BRAF V600E突变的儿童胶质瘤在目前的放化疗策略下预后较差。
为此,INC国际神经外科顾问团成员、国际神经外科前主席、加拿大多伦多大学儿童医院脑瘤研究中心主席James T. Rutka教授及其研究团队收集了来自多个国家的29个中心的BRAF V600E突变胶质瘤患者的临床、影像学、分子和预后信息。目的是研究靶向BRAF控制在这些肿瘤中的作用。

儿童低级别胶质瘤(PLGGs)是儿童较为常见的脑肿瘤。在过去10年中,这一异质性肿瘤的分子结构已经得到了描述,确定了大多数肿瘤中RAS/丝裂原活化蛋白激酶(MAPK)通路的改变。较近的数据表明结果PLGG患者的临床表现和预后不同。
BRAF V600E是PLGG中二常见的突变,占15%到20%,发生在大多数病理亚型中。在常见的PLGG分子亚型中,包括NF1突变型和KIAA1549-BRAF融合亚型,具有BRAF V600E突变的PLGGs存活率较差,是与纯合CDKN2A缺失共存时。BRAF V600E突变的PLGGs也有更高的恶性转化倾向。虽然CDKN2A缺失在整体预后和转化中的作用已经被很好的描述,但是这种改变是否会影响治疗反应尚不清楚。
对于不能切除或进行性PLGG患者的护理标准包括化疗,放疗通常保留给进行性病例。目前的化疗策略能使肿瘤控制在40%到50%之间病人。放射治疗达到了很好的肿瘤控制,接近80%,但伴随着继发性恶性肿瘤、缺血性事件和认知不良反应的风险增加。总体而言,采用这种疗法的PLGG的长期结果是有利的,总生存率(OS)20岁时为90%。
相比之下,在BRAF V600E突变的PLGG中,只有不到30%的患者使用标准疗法(包括放疗和化疗)实现肿瘤控制,这表明癌症的临床生物学组不同。这些数据表明,对于儿童BRAF V600E——突变的PLGG,需要一种新的方法。此外,儿童高级胶质瘤(PHGG)仍然是较具挑战性的儿童肿瘤之一。不管治疗策略,包括手术、放疗和化疗,预后仍然很差,5年生存率只有10%。一级和二级转化BRAF V600E–突变PHGGs与目前的放化疗方法具有相似的严重后果。
BRAFV600E突变是结肠癌、黑色素瘤和其他成人癌症中常见的一种体细胞事件,这导致了针对BRAFV600E控制的靶向治疗的发展。这改变了黑色素瘤治疗的前景,提高了生存率,但较终对这种单一疗法产生了耐药性。一些病例报告也描述了BRAF V600E突变PLGG患者的反应。然而,这些患者缺乏使用BRAF控制的临床经验。
为了满足这一迫切需要,我们从多个主要的神经肿瘤中心收集了大量BRAF控制剂单药治疗患者的临床和分子数据。我们的研究结果为BRAF控制对这一高危人群的影响提供了新的见解。
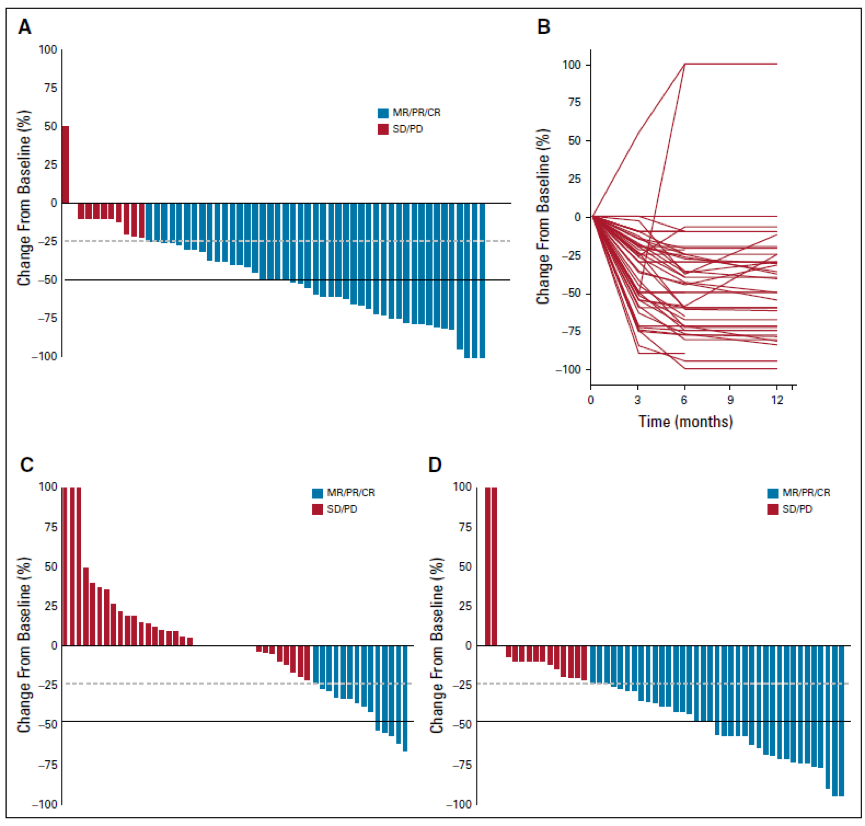
据我们所知,在这里,我们报告了迄今为止规模较大的一组儿童BRAF V600E突变胶质瘤患者接受BRAF控制治疗。我们的数据显示,使用这种靶向治疗方法,BRAF V600E突变的PLGG的初始反应和持续的疾病控制效果较好。我们还发现了几个关键的概念,对临床医生在这些儿童癌症的较佳治疗至关重要。尽管我们队列中的大多数患者是用BRAF控制治疗的复发性疾病,但是BRAF V600E突变的PLGG对BRAF控制的反应是的。在80%的PLGGs中观察到总的ORs,超过半数的PLGGs显示肿瘤大小减小≥50%。值得注意的是,这些反应通常在3个月内达到,与化疗和/或放疗方法观察到的缓慢反应和大部分稳定相比。然而,BRAF控制在少数肿瘤中导致CR。究竟是一个具有不同肿瘤含量突变细胞的异质性细胞群导致了这些异质性反应,还是只有周期性细胞对BRAF控制敏感尚待阐明。
由于BRAF控制目前只用于复发性肿瘤,我们的数据表明早期应用BRAF控制治疗有可能预防PLGG患者的病态性和后遗症。文献中已经报道了视觉状态、癫痫控制和其他神经功能紊乱的好转。虽然我们没有收集这些数据,但是这个队列中的细胞减少可能与临床和神经功能的好转有关。这些临床好转在大多数用常规放化疗治疗的PLGGs中是不常见的,因此,在BRAF控制向前发展的前瞻性试验中,这些好转应该是更好的特征。
67例患者接受BRAF控制治疗(儿童低级别胶质瘤[PLGGs],n=56;儿童高级胶质瘤[PHGGs],n=11)长达5.6年。目的观察到80%的PLGGs合适率,而常规化疗的合适率为28%(P.001)。这些反应迅速(中位数为4个月),86%的肿瘤在接受治疗时可持续5年。停止BRAF控制后,76.5%(13/17)的PLGG患者出现快速进展(中位数为2.3个月)。然而,经过90%的控制后,布拉根的反应达到了目标。传统治疗中预后差的因素,如CDKN2A的纯合子缺失,与BRAF控制无反应无关。相比之下,只有36%的PHGG患者对BRAF控制有反应,除了一个肿瘤在18个月内进展。在PLGG中,BRAF控制与化疗的反应分别转化为49.6%(95%CI,35.3%-69.5%)和29.8%(95%CI,20%-44.4%)的3年无进展生存率(P=0.02)。
总之,这项研究中的数据表明大多数BRAF V600E突变的PLGG对BRAF控制的初始反应率和持续反应率都很高。如果BRAF控制中断,这种效应可能会消失,并且BRAF V600E突变PHGG的控制效果较差。尽管这些发现支持将BRAF控制纳入BRAF V600E突变PLGG的治疗中的潜力,但这种持续治疗的长期疗效和潜在风险需要充分探讨。需要进一步的研究来更好地理解耐药的机制,预先使用BRAF控制,以及BRAF控制与放疗、化疗或其他靶向联合应用的可能性。较后,了解BRAF V600E突变的儿童胶质瘤的伴随改变的作用将有助于设计治疗这些高危肿瘤的新方法。
据悉,James T. Rutka教授曾连续三年任职国际神经外科学院院长,同时还是美洲神经外科学院前院长、美洲神经外科医师协会主席,如今是当今国际神经外科杂志《Journal of Neurosurgery》主编,其自身发表了超过500多篇的文章,著有神经外科专著多本,在临床上的研究方向以颅内肿瘤为主,对胶质瘤、纤维瘤、颅咽管瘤、室管膜瘤、松果体区肿瘤等具有多年的临床经验,擅长儿童脑瘤和癫痫等外科治疗,包括间质激光热治疗(LITT)、清醒开颅术等显微外科手术。
由James T. Rutka教授领衔的脑瘤实验室在研究脑肿瘤生长和侵袭的机制方面颇有成就,并在Sunnybrook健康科学中心和多伦多大学生物材料和生物医学工程研究所的合作下,正在设计一种基于纳米颗粒的输送系统,作为治疗胶质瘤的一种新方法。
参考文献:ascopubs.org




