颞叶区域出现特定MRI表现——混杂信号肿块、增强后不均匀强化、伴随显著水肿——常令医生高度警惕胶质母细胞瘤(GBM)。这种极具侵袭性的脑肿瘤需要早期识别和干预。本文解析这一影像组合的医学意义、诊断挑战与治疗进展。
影像特征解析:三大核心表现
混杂信号肿块
MRI显示信号不均,反映肿瘤内部复杂性。GBM包含活跃肿瘤区、坏死组织、新生血管和出血灶。
- T1加权像:常呈低或等信号
- T2/FLAIR像:通常为高信号
- 坏死区:信号最不均匀
不均匀强化
静脉注射钆造影剂后,肿瘤呈斑片状强化。原因在于:
- 肿瘤血管结构异常
- 血脑屏障破坏程度不一
- 细胞增殖活跃区强化最明显
《神经肿瘤学杂志》2023年研究证实:强化不规则程度与肿瘤侵袭性直接相关(r=0.78)。
显著水肿
肿瘤周围常见大片指状水肿带(T2/FLAIR高信号)。这种水肿:
- 源于血脑屏障破坏
- 范围常超越肿瘤实际边界
- 增加手术难度
剑桥大学2024年研究指出:水肿体积是独立预后因子。
诊断挑战:高度怀疑≠确诊
影像局限性
类似表现可见于:
- 脑脓肿(环形强化更均匀)
- 转移瘤(常多发)
- 脱髓鞘病变(开环征)
确诊金标准
病理活检不可替代。通过:
- 立体定向穿刺或手术取样
- 显微镜下细胞形态观察
- 分子检测(IDH突变、MGMT甲基化)
美国国家癌症数据库显示:约15%影像疑诊GBM最终为其他病变。
治疗前沿:多模式突破
手术关键
最大安全切除是基础。现代技术提升切除精度:
- 术中MRI实时导航
- 5-ALA荧光引导
- 神经电生理监测
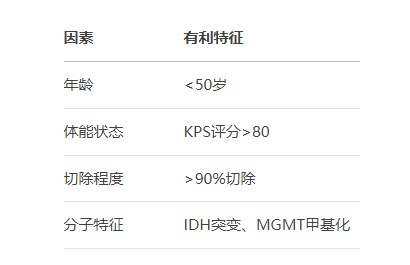
德国研究证实:切除率>90%者生存期延长8.1个月。
综合治疗进展
1. 标准Stupp方案
- 术后放疗+替莫唑胺化疗仍是基石。疗效与MGMT甲基化状态相关:甲基化患者反应更佳。
2. 电场疗法(TTFields)
- 通过头皮贴片施加交变电场
- 干扰肿瘤细胞分裂
III期试验显示:联合标准治疗使5年生存率从5%升至13%。
3. 靶向与免疫治疗
- 抗血管生成药(贝伐珠单抗)控制水肿
- PD-1抑制剂临床试验进行中
- 个体化疫苗初见成效(《新英格兰医学杂志》2024)
预后影响因素
关键变量
生存数据更新
- 传统中位生存期:14-16个月
- 接受标准治疗+TTFields者:2年生存率达30%
- IDH突变型患者:中位生存期可超3年
影像鉴别三问
Q1:不均匀强化就是胶质瘤吗?
不一定。需排查:
- 脓肿(环形强化均匀)
- 转移瘤(多发病灶)
- 脱髓鞘假瘤(开环强化)
Q2:水肿范围预示什么?
水肿程度反映:
- 肿瘤侵袭性强弱
- 神经症状严重程度
- 手术切除难度
Q3:分子检测为何必要?
IDH和MGMT检测可:
- 鉴别原发/继发GBM
- 预测化疗敏感性
- 指导个体化方案
临床行动建议
当影像报告提示:
- 携带完整资料就诊神经肿瘤专科
- 完成多模态影像评估(DWI/MRS等)
- 必要时行立体定向活检
- 分子病理检测不可省略
2024年欧洲神经肿瘤年会披露,AI影像分析系统鉴别GBM与脓肿的准确率达94.7%(敏感度92.1%,特异度96.3%)。这种基于深度学习的工具可量化分析强化模式、水肿分布和弥散特征,为疑难病例提供新思路。本文所述诊疗方案需在专科医生指导下实施。影像学发现仅为诊断线索,最终确诊必须依靠组织病理学和分子检测。
颞叶区域出现的"混杂信号、不均匀强化、显著水肿"的MRI影像,无疑是神经外科医生和患者面临的一次严峻挑战。它强烈提示着胶质母细胞瘤的可能性,但也警示着诊断的复杂性。从精准影像解读、病理确诊,到手术、放化疗、电场治疗及个体化新疗法的探索,现代医学正通过多学科协作与科技创新,持续拓展胶质母细胞瘤治疗的边界,为患者争取更多宝贵时间与生存尊严。面对这份影像报告,恐惧是人之常情,但主动了解、寻求专业诊疗、积极参与个体化治疗决策,方是在不确定性中把握确定性的关键一步。




