胶质瘤仍然是国际上较丰富的原发性脑肿瘤,胶质母细胞瘤占多数。 GBMs较常见为孤立性病变,很少出现多发性GBMs(据报道发病率为2-20%)根据是否存在通过既定途径的扩散或生长、通过连合或其他途径(即胼胝体、穹窿、内囊或中间马萨)的扩散,或通过脑脊液通道的扩散,多个GBM进一步分为多灶性和多中心性。由于少见,这些病变尚未得到广泛研究。
案例报告:
一名17岁男性,表现为颅内压增高和癫痫发作,放射学检查显示2个多中心病灶;一个在额叶,另一个在颞叶,都被完全切除。经组织病理学分析诊断为GBM,接受术后放疗6个月。在1年内保持无症状,再次在1年的随访中,他发现有3个病灶复发;一个在右额叶,二个在右颞叶,三个在右顶叶,其间没有任何神经连接。对目标额部和颞部病变进行完全切除手术,以减少肿块效应,术后计划进一步辅助放化疗【图1】。
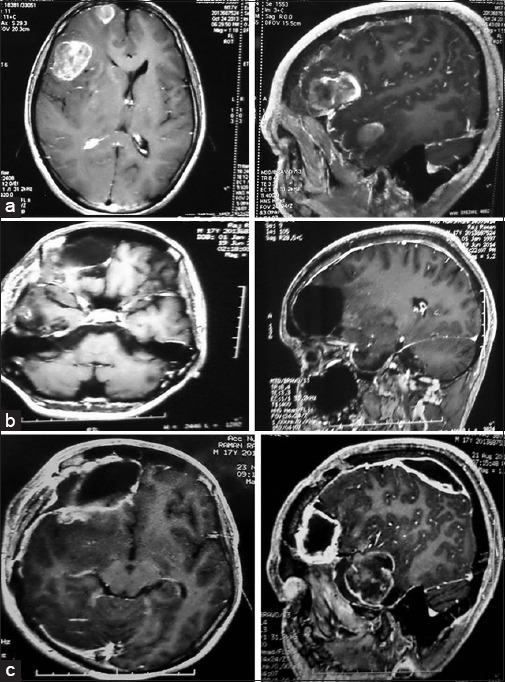
图1:磁共振成像对比显示多中心胶质母细胞瘤(a),术后图像(b)和相同部位以及同侧顶叶术后1年复发(c)
胶质瘤仍然是国际上发病率较高的的原发性脑肿瘤,GBM占大多数。尽管在过去的几十年里,GBMs的诊断和治疗领域取得了许多科学进展,但它仍然是一种致命的疾病,即使采用目前较好的治疗方法,中位生存期也不超过3个月。
胶质母细胞瘤通常表现为单一实质病变,多发性胶质母细胞瘤少见。多发性GBM可以是多灶性的,也可以是多中心性的,全部的病变可能同时出现(同步),也可能随后出现(异时)。由于稀有性,关于多发GBM的文献很少。
多发性神经胶质瘤的真实发病率尚不清楚。然而,各种研究表明其发病率在2%至20%之间。多灶性GBM的发病率可能更低。磁共振成像的广泛应用和手术切除的增加,甚至在多发性肿瘤中的使用也增加了现代对这些病变的报道。在我们的研究中,多发性GBM的发生率为全部GBM的11.7%。
布德卡较初将多发性胶质瘤分为四类:弥漫型、多发性、多中心型和多器官型。1963年,巴兹多夫和马拉默德区分了两种类型的多发性胶质瘤,即多灶性和多中心性胶质瘤。多灶性胶质瘤是由肿瘤细胞通过预制途径如连合纤维、脑脊液途径或局部转移的扩散或生长引起的。另一方面,多中心胶质瘤位于不同的叶或半球,它们的同时存在不能用前面提到的机制来解释。将多个GBM标记为多灶性或多中心性的临床意义正在消失。各种研究表明,两组之间没有明显的临床应用差异。我们没有发现多灶性和多中心性GBMs的病理学有任何差异。出于这个原因,我们没有将基于性别的方法区分为这些组,而是将它们组合成多个基于性别的方法。
多灶性/中心性胶质瘤的确切发病机制尚不清楚。然而,较近的研究较大地丰富了我们关于这些损伤发生的现有知识。威利斯提出的假设表明,两个步骤的肿瘤发生导致多种胶质瘤。在一阶段,大面积或整个大脑经历了一些被标记为初始的转变。这一步被认为是使大脑容易受到坦率的恶性变化的影响。在二步中,由于各种刺激,如机械的、病毒的或生物化学的,在多个位点发生过度的细胞增殖,在不同的地方产生胶质瘤。这个被称为“促进”的过程也解释了这些肿瘤的异时发展。另一方面,zulch认为多中心性实际上是一种沿着未知途径的转移。
从病理学角度来看,GBM似乎是多发性GBM较常见的类型。然而,其他胶质瘤,如低级星形细胞瘤和室管膜瘤,也有报道以多中心方式出现。大多数情况下,病变位于幕上,但有时也可能遇到幕上和幕下联合病变。有趣的是,无论病变是多灶性还是多中心性,这些都是存在的。这些病变也见于脑胶质瘤病,它也是一种浸润性肿瘤,虽然组织病理学上为二级,但其生物学行为为三级。类似地,这些多发性胶质细胞瘤的表现可能比孤立性GBMs差得多。
Kyritsis等人19例多灶性胶质瘤患者中有6例报告了种系p53基因突变。孔等人显示更大比例的c-Met过表达GBMs具有多灶性特征。他们还显示了c-Met表达与基质金属蛋白酶2和9之间的联系,这可以解释侵袭性和多灶性特征的增加。 Lim等人我们发现,表现为与脑室下区(含有神经干细胞)接触并伴有皮质浸润的GBMs与多灶性疾病的出现和复发相关。 Patil等人分析磷酸化丝裂原活化蛋白激酶、磷酸酶和张力蛋白同源物、O6-甲基鸟嘌呤-DNA甲基转移酶、层粘连蛋白b1和b2以及表皮生长因子受体扩增的表达,发现多灶性和单灶性GBM组之间没有差异。
多发性病变主要在核磁共振成像/计算机断层扫描中发现。症状通常是由于这些病变中的一个,或者是由于涉及的大脑区域的大小或功能障碍。虽然我们承认核磁共振成像在检测这些多种病变方面是有用的,但我们需理解,仅仅根据成像做出明确的诊断并不容易。常见的影像学差异包括脑脓肿、转移瘤、淋巴瘤和多发性硬化等脱髓鞘疾病。磁共振波谱可能有助于区分各种可能性。
对这些病变的理想处理仍有争议。这源于相互矛盾的报道,其中一端建议根本不治疗,而另一端主张治疗(较大限度的手术切除,然后化疗放疗)。然而,外科活检是建立诊断和决定进一步辅助治疗所需要的。立体定向活检用于深部病变,而开放手术减压用于具有颅内压增高特征的较大病变。
这些多发性GBM的预后是否比单独的GBM更差尚不清楚。在帕萨的一项研究中等人,并没有发现两者之间有任何生存差异。然而,在另一项研究中,作者发现多重组的存活率比单独组更差。在控制年龄、KPS评分、治疗和切除范围并进行匹配后,由帕蒂尔进行研究等人显示新诊断为多灶性GBM的患者的存活率明显低于孤立性GBM患者(分别为6个月和11个月)。在现代替莫唑胺时代,多灶性疾病患者的1年和2年生存率分别仅为28.5%和4.3%。
结论
多发胶质瘤占全部胶质瘤的近11.7%。升高的ICP是较常见的表现形式。全部这些损伤都是对比增强的。组织病理学上,大多数病变表现为二级结构,如神经周围和血管周围卫星病、皮下肿瘤细胞积聚、GFAP阴性和高增殖指数。全部这些发现表明,这些病变可能比孤立的对应病变更具侵袭性。




