引言:“脑干胶质瘤到底怎么回事?有治好的没?这个病到底多严重?现在在医院,无知带来了无限的恐惧。”一名脑干胶质瘤病友在网上发了这样一个问题,引来了无数胶质瘤乃至脑干胶质瘤患者及家属的共鸣。刚发现疾病的不了解带来的恐惧,到无数次求医路上的闭门羹,甚至病友群不停传来的坏消息……其中一位病友家属这样回复道:“胶质瘤一个我既熟悉,也不愿提起的魔鬼,我能称魔鬼说明它凶险、残忍、血腥,没错它亲手夺走了我疼爱的老父亲年仅65岁的生命。这个病可活可死,可久可短,可重可轻,可不影响生活可顷刻间家庭崩塌,但如果是脑干胶质瘤,如果你发的准确的话,我认为凶多吉少,而且我也提醒你这个病的名称你需说的一字不差,因为一字之差谬以千里,脑干是人体的神经中枢,是人体的较后一道防线,一旦它被侵入,基本上就宣告了死亡,所以如果真是这个病,我说话不好听,那这个病人基本就没什么机会了,也基本不存在手术的可能,更不要说医好……”

脑干胶质瘤手术好还是不手术好?一般来说,恶性肿瘤的手术切除对患者生存期的延长起到很重要的作用,但是由于脑干掌控个体的生命,包括心跳、呼吸、消化等重要生理功能,并且在延髓和脑桥(脑干从解剖学角度可以分为三个部分:中脑、脑桥和延髓)里有调节心血管运动、呼吸、吞咽、呕吐等重要生理活动的反射中枢。若这些神经中枢受损伤,将引起心脏搏动、血压的严重障碍,甚至危及生命。所以如果肿瘤的生长侵犯了功能区,手术的困难是很大的。
当脑干上长了胶质瘤,真的等于被判了“死刑”吗?
当然,也不是全部的脑干胶质瘤预后都很糟糕,预后和治疗方案取决于肿瘤的组织学特征和在脑干内的位置。根据脑干胶质瘤的侵袭程度可以简单的分为两大类,弥漫性脑干胶质瘤(较常见于脑桥)和局灶性脑干胶质瘤(大多位于中脑和延髓)。
儿童中,起源于脑干(中脑、脑桥和延髓)的胶质瘤占全部中枢神经系统(CNS)肿瘤的10%-20%。脑干胶质瘤具有异质性,从几乎无需治疗的低级别肿瘤到尽管治疗仍迅速致命的高级别肿瘤都有发生。预后和治疗方案取决于肿瘤的组织学特征和在脑干内的位置。
局灶性脑干胶质瘤通常起自中脑和延髓,通常为边界清楚的离散性肿瘤。组织学上,这些肿瘤较常为毛细胞型或弥漫性星形细胞瘤,偶尔为节细胞胶质瘤,全部都是低级别肿瘤。局灶性脑干胶质瘤与颅后窝和幕上低级别胶质瘤有很多相同的生物学特征,分析参与其发病机制的信号通路取得了很大进展。
几乎全部的弥漫性脑干胶质瘤进展都迅速,预后较差;而局灶性脑干胶质瘤相对而言恶性程度较低,预后相对较好。那么局灶性胶质瘤又包括哪些类型呢?局灶性胶质瘤该如何治疗?是否真的可以通过手术获得良好预后呢?
局灶性胶质瘤病理学
组织病理学—局灶性脑干胶质瘤通常起自中脑和延髓,通常为边界清楚的离散性肿瘤。组织学上,这些肿瘤较常为毛细胞型或弥漫性星形细胞瘤,偶尔为节细胞胶质瘤,全部都是低级别肿瘤。是在非毛细胞型肿瘤中,可能出现局部侵袭性生长或水肿迹象。局灶性脑干胶质瘤与颅后窝和幕上低级别胶质瘤有很多相同的生物学特征,包括关键的分子遗传学改变。
发生于脑桥以外的脑干胶质瘤中,多达80%是低级别肿瘤,即WHOⅠ级和Ⅱ级肿瘤。其余20%是高级别胶质瘤。
分子遗传学—组织学诊断应尽量辅以分子学诊断,后者可提供重要的诊断、预后和治疗信息。
儿童低级别胶质瘤(包括脑干胶质瘤)的分子分析确认了毛细胞型星形细胞瘤中涉及BRAF基因的特征性复制(KIAA1549-BRAF融合),以及一些纤维型星形细胞瘤、节细胞胶质瘤和多形性黄色星形细胞瘤中的突变(BRAF V600E)。结合1型神经纤维瘤病与低级别星形细胞瘤间的已知关联,Ras/Raf通路对这些肿瘤预后及治疗方案的影响备受关注。
突变的异柠檬酸脱氢酶1型(isocitrate dehydrogenase type 1,IDH1)是成人低级别胶质瘤另一个重要的预后变量。除了青少年和年轻成人,儿童低级别胶质瘤很少携带IDH1突变,具体原因尚不清楚。
临床特征:不同位置有何不同?
大多数低级别脑干胶质瘤儿童有相对较长的轻微症状和体征病史,可能已存在多年。
患者的症状和体征往往反映肿瘤所在部位、是否有脑积水和/或患儿的年龄。大多数肿瘤会引起程度的颈僵硬或不适,部分患者甚至可表现为斜颈。
●中脑或延髓较小的局灶性肿瘤常表现隐匿,有很长的定位表现病史,如孤立的脑神经缺陷或对侧轻偏瘫。颅内压(intracranial pressure,ICP)增高的症状和体征并不常见。
●背侧外生性肿瘤和顶盖(即中脑上部/喙部的背侧面)局灶性肿瘤通常因导水管闭塞和脑积水导致头痛、呕吐和共济失调。约一半的患者存在颅神经缺陷,但是长束体征少见。可能出现脑干功能障碍(如Parinaud综合征)相关症状。
●延髓肿瘤可伴有脑神经功能障碍、吞咽困难、说话带有鼻音和呼吸暂停。患者也可能出现无力、共济失调、恶心和呕吐。少见情况下,局灶性脑桥肿瘤可引起面神经和听神经功能障碍。
●延髓-颈髓交界处肿瘤可引起上运动神经元功能障碍导致的轻偏瘫或四肢轻瘫,以及下运动神经功能障碍导致的无力、肌肉萎缩及反射消失。脑积水并不常见,但患者可能会出现呼吸暂停、感觉障碍、头痛、呕吐和脑神经病变。
局灶性脑干胶质瘤的诊断性评估
由于大多数病灶位于功能区,往往无法或难以获得足够的组织样本,故影像学检查是脑干肿瘤诊断和分类的标准方法。
根据MRI和磁共振波谱分析(MRS)的结果常可鉴别低级别与高级别脑干胶质瘤。如果通过影像学不能做出诊断,则需要行立体定向活检。可切除的肿瘤一般在手术时做出诊断,无需预先活检。
MRI表现—许多脑干肿瘤在CT上呈等密度,因此其优选影像学检查是脑MRI平扫和增强扫描。
在MRI上,低级别局灶性脑干胶质瘤较常表现为有限体积(<2cm)的肿块,可能呈囊性、边界清楚、非浸润性,且无相关水肿。这类肿瘤在T1加权像上通常为等信号或低信号,在T2加权像上为高信号,静脉注射对比剂后呈均匀且明亮的增强。弥散张量成像(DTI)和白质束成像有助于显示局灶性脑干肿瘤中运动和感觉束的轴突变性。这些图像序列可能有助于制定活检或减瘤的手术计划。此外,高级影像学检查可能有助于评估治疗后功能束恢复的可能性。中脑局灶性肿瘤可有钙化,在影像学上对比增强不明显。
MRI对顶盖胶质瘤特别有用,其影像学外观通常均匀,具有非增强的顶盖板增厚(影像1)。这些肿瘤的非浸润性特征、背侧外生性生长模式及伴随的脑积水均提示其为低级别肿瘤。增强模式也可为诊断提供支持:Ⅰ级胶质瘤常有弥漫性钆增强,Ⅱ级胶质瘤常常无增强,而高级别脑桥胶质瘤常有环状增强。顶盖板肿瘤的诊断通常依据其特征性MRI表现及存在脑积水。
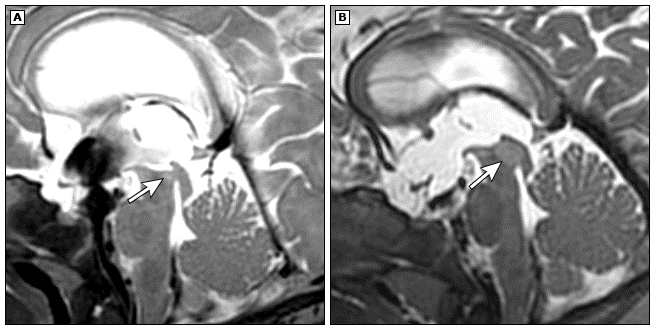
影像1:顶盖神经胶质瘤。诊断时(A)和10个月观察后(B)的矢状T2加权图像显示T2高信号进行性顶盖肿块病变(箭头)阻塞导水管。
延髓-颈髓肿瘤的MRI信号特征与其他低级别星形细胞瘤相似,为T2高信号、T1低信号,通常存在囊性区域,往往位于背侧外生性部分内(影像2)。有背侧外生性部分的肿瘤常伴有脑积水。
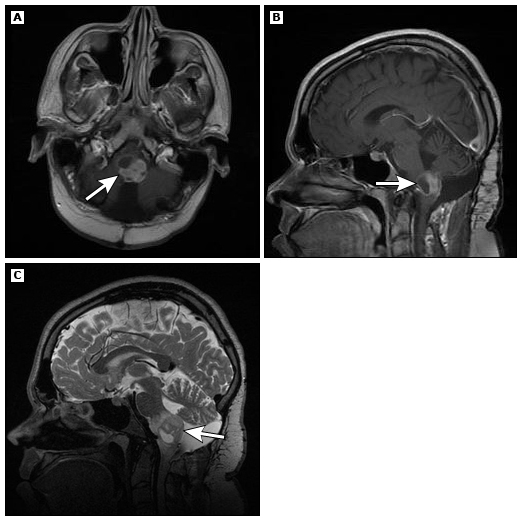
影像2:延髓背侧神经节胶质瘤。增强后轴位(A)和矢状位(B)T1加权像和矢状位T2加权像(C)显示一个2.4×2.5 cm的囊实性T2高信号肿块,病灶中心位于脊髓背侧(箭头)。
磁共振波谱分析—MRS可辅助诊断脑肿瘤,有助于鉴别局部浸润性脑肿瘤与其他边界清楚的颅内病变。通过测定肿瘤相关性胆碱(Cho)和N-乙酰天冬氨酸(NAA)及它们的比值(Cho:NAA),MRS可帮助鉴别肿瘤的级别高低。
局灶性脑干胶质瘤的治疗
脑干胶质瘤的治疗需考虑肿瘤的解剖位置,后者决定了患者的症状及手术切除入路是否可及。脑干低级别胶质瘤患者的远期预后较好。
较好是由一个团队进行治疗,包括经验丰富的神经外科医生、放射肿瘤科医生、神经肿瘤科医生,以及社会心理工作者、教育专家、理疗师和作业治疗师。拥有神经肿瘤专科团队的化三级医疗中心是实施上述多学科治疗的较佳选择。
治疗方案:在局灶性脑干胶质瘤的治疗中,手术切除、放疗(RT)和化疗都有各自的作用。
手术治疗
脑干胶质瘤位于CNS较重要的功能区之一,过去认为无法实施手术,故大多数患者接受放疗。
然而,随着术中影像学技术和引导技术的进步,外科医生较大水平切除肿瘤并保存正常组织和功能的能力已提高。尽管目前尚无随机试验,但是对于手术路径可抵达的局灶性脑干胶质瘤,如某些病例的延髓-颈髓交界处肿瘤以及背侧外生性肿瘤,优选手术切除。PET可精确定位脑干肿瘤内较高级别区域,可帮助指导活检部位。对于禁忌切除的儿童和成人患者,立体定向活检能提供重要的组织学和分子信息,以指导进一步治疗。
已行切除的肿瘤中大约有30%会出现进展并需要进一步治疗。如果手术路径可抵达病变,可考虑再次手术。对于其他患者,较合理的方案分别是对儿童进行化疗和对成人进行局部放疗。
放疗
对于手术路径不能抵达的脑干局灶性肿瘤,放疗是重要替代手段。采用标准分割的外照射治疗可控制约50%-70%的局灶性病变。脑干胶质瘤中放疗应用的进展主要集中在通过限制对正常组织的辐射剂量降低并发症发生率。新型适形放疗技术包括立体定向放射外科(SRS)、分次立体定向放疗(SRT)、调强放疗(IMRT)、容积旋转调强放疗(VMAT)和质子放疗,这些技术可尽量减少对一般正常脑组织的照射,这对脑干肿瘤放疗重要,因为脑干肿瘤常常靠近垂体和视神经等重要结构。
尽管放疗可实现长期无进展生存,但可伴严重并发症,特别是对较年幼的儿童。长期影响包括垂体和下丘脑受到放射后引起生长减缓和其他内分泌疾病,认知和听力障碍,可导致脑卒中的血管狭窄,以及治疗引起的继发性恶性肿瘤的风险。因此,放疗应尽量仅限于成人和年龄较大的儿童,以尽可能降低远期并发症发生率。头颅照射的迟发性并发症详见其他专题。
化疗
化疗在避免或推迟脑干胶质瘤患儿接受放疗中的作用越来越重要。化疗可使肿瘤生长保持稳定,还能避免或推迟年幼儿童的放疗需求,对生存质量产生影响。每周接受长春新碱和卡铂治疗的低级别胶质瘤儿童中,约40%得到客观缓解,疾病在一段时间内保持稳定的比例可能更高。例如,一篇报道发现,2年和3年无进展生存率分别为75%和68%。已观察到其他化疗方案[如6-硫鸟嘌呤、丙卡巴肼、洛莫司汀和长春新碱(TPCV)]有相似的结果。
靶向于儿童低级别胶质瘤中特定通路的药物也已进入临床试验。尽管特定人群中的早期数据令人鼓舞,但一些治疗刺激了肿瘤生长,而不是控制肿瘤生长,这凸显了儿童低级别胶质瘤的复杂信号通路。因此,这些靶向控制剂应仅用于前瞻性临床试验。




