OPG的一个不同实体是裂前视神经的胶质瘤,不涉及视交叉本身。这些肿瘤表现可以是仅在硬膜内、仅在眶内或在两个腔室中。这些肿瘤的自然病史显示进展率高达60%,自发消退率为18%,后者仅与NF1相关。据报道,大约一半的患者视力下降。在交叉前OPG中,对于失明或功能性视力丧失的患者,通过手术进行治疗是可行的。是对于眼眶内有明显肿瘤肿块导致眼球突出,有时会引起眼眶疼痛的患者,手术是一个很好的选择,因为与化疗或放疗相反,眼球突出和疼痛会立即被切除,并且避免儿童长期化疗或长期放射治疗。受影响视神经的裂前横断可以阻止肿瘤生长到交叉。然而,手术需保持动眼神经功能和美容完整性。除其他外,已经提出了翼点方法。有学者报告了视神经OPG的较大队列,他们在选定的病例中提出了手术干预。
手术案例研究
对Tuebingen大学医院和CharitéBerlin儿科神经外科的儿科患者数据库进行回顾性分析,以确定诊断时年龄小于18岁的孤立性裂前视神经胶质瘤和的眶内肿瘤肿块患者,其中进行了从眼球到交叉的手术切除。在Tuebingen和Berlin,采用了不同的手术方法和策略。手术指征为患眼失明/视力不正常、眼球突出畸形、疼痛和有记录的肿瘤生长。通常存在多种因素的组合。全部术前磁共振成像均显示肿瘤从眼眶向视神经管生长增强,在8/10的病例中,硬膜内肿瘤进一步扩展,影响同侧视神经,但不影响视交叉(图1)。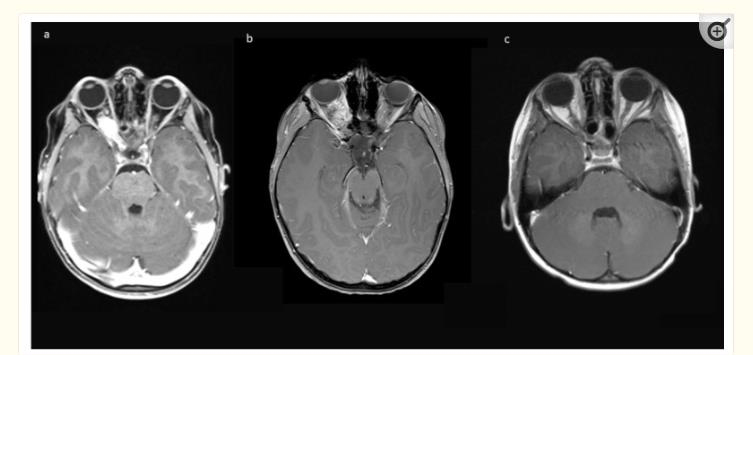
对出院和随访报告、眼科检查和神经病理学报告(包括甲基化阵列)进行图表回顾和回顾性分析,以获取有关病史、症状、结果和进一步治疗的信息。
眼球突出的量化
如前所述,通过MRI扫描和量化评估临床可见的突眼。统计分析
使用SPSS统计25(IBM,Armonk,NY,USA)分析统计数据。连续数据以平均值(±标准差)表示,而分类数据以百分比表示。通过Levene检验检验连续变量的方差相等性。使用非配对或配对t检验比较方差相等的正态分布参数变量,否则执行Mann-Whitney U检验。标称变量采用Fisher精确检验。p值<0.05被认为是的。手术入路
在吐宾根(A组),采用额颞部皮肤切口,然后进行眶上开颅术。硬膜外暴露眼眶后,通过截骨术打开眼眶顶部,用金刚石钻将视神经管拔出,使其回到硬脑膜皱襞。未钻取前床突,注意不要打开视神经管内侧的筛窦细胞。在眶周筋膜T形开口后,一三叉神经的额支和上直肌/提上睑肌被解剖并侧向收缩,包括从下方进入肌肉的上动眼神经支,以暴露肿瘤。在这种方法中不会遇到外展神经。鼻睫神经在眶中穿过视神经,滑车神经在圆锥附近穿过,以避免在切除过程中受伤。然后,打开覆盖肿瘤的视神经鞘的硬脑膜,进行硬膜内肿瘤切除,沿着神经鞘向前,直到到达眼球。在硬脑膜内部,没有发现相关的神经血管结构。在尽可能靠近眼球的视神经横断层面上,应特别注意不要损伤眼球。然后,肿瘤在视神经鞘内向后延伸至视神经管。需要避免眶锥上肌的肌肉附着,并避免损伤可见滑车神经。然后,在视神经管内的肌肉附着物后面继续硬膜内切除,直到脑脊液从硬膜内腔流出。此时,硬脑膜在颅底水平呈直线打开;解剖硬膜内视神经、视交叉和颈动脉;视神经在肿瘤可见端和交叉之间被切断。如果肿瘤延伸接近交叉或紧靠交叉,需注意不要进入交叉,以免交叉纤维受损。
硬脑膜外视神经管与颈内动脉和眼动脉上方硬脑膜内室交界处的剩余肿瘤部分,通过硬膜内和硬膜外途径小心地从其附着物中取出,较后取出。眼动脉可以在硬膜内一毫米处显示;在这个过渡区进行解剖时需小心,不要用力,这样可以避免对动脉的损伤。肿瘤切除后,在视神经管的较开始处也可以看到动脉,但主要在硬脑膜视神经鞘后面,因此在那里不会受到威胁,就像下动眼神经在眶内分支一样。用纤维蛋白胶固定的肌肉堵塞视神经管,然后用6-0缝线重建眶周筋膜。用PDS缝线替换并固定眶顶骨,然后闭合硬脑膜。对于15岁以下的儿童,开颅术用PDS缝线重新固定,否则使用钛板。术中照片如图2所示。
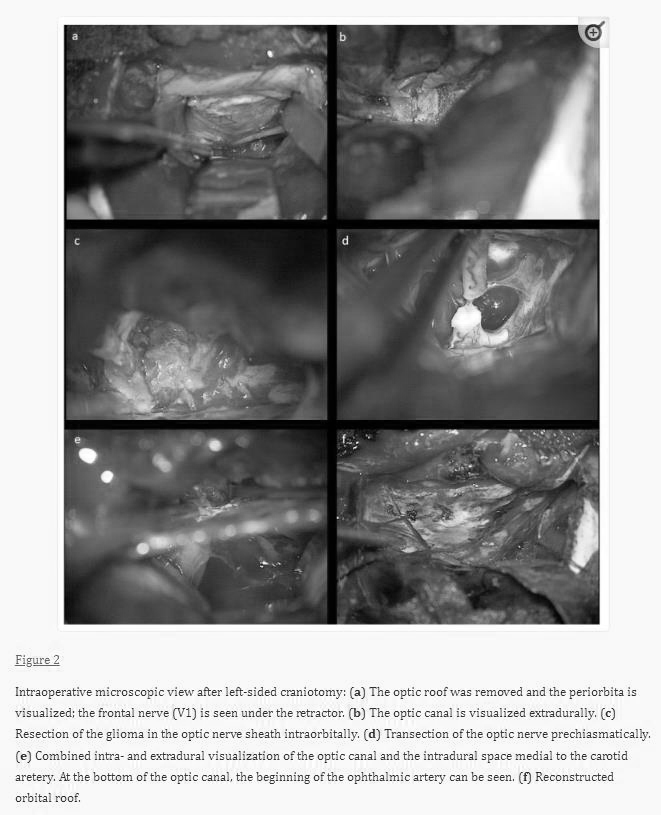
在Berlin(B组),在切开眼轮匝肌、颞肌骨膜和前部后,采用眉侧切口暴露眶上缘。使用压电手术开颅器,通过保持眶上神经内侧完整,包括额骨颧突,进行眶上小骨切开术。开颅手术暴露了眶周和额叶基底硬脑膜。巩膜切开后,识别并结扎直肌,以在肿瘤切除过程中控制肌肉结构。如前所述,打开近眼眶,固定眶内结构。在超声引导下,减少并收缩眶内脂肪,以准备向视神经方向解剖。打开视神经鞘,超声抽吸清除肿瘤。在获得足够的空间后,确定眼球后部和视神经的插入。神经在靠近球茎的地方被切断。然后,向眶锥方向解剖神经和肿瘤的残余部分。就在视神经管前方,解剖了视神经的较后段。止血后,用5-0 vicryl缝合近眼眶。然后,打开硬脑膜,采用额下入路识别视神经的颅内视交叉前部分。这部分被凝固和切割,留下几毫米的神经,以避免伤害交叉。硬脑膜是密封的。再次插入眶上骨瓣,用钛板固定。在轮匝肌适应和皮下缝合后,将皮肤粘合。撤回直肌结扎,缝合巩膜。
结果
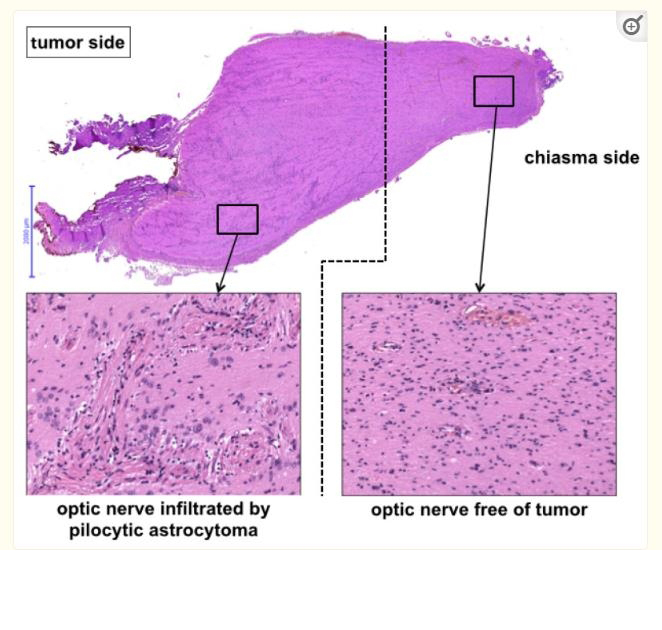
在我们的Tuebingen数据库中,共识别出77名患有OPG的儿童,其中8名连续儿童符合单侧裂孔前OPG的纳入标准。另外两名来自柏林的眶上小骨瓣开颅术患者被纳入研究。患者主要为女性(n=6,60%)。诊断时的平均年龄为4.4岁(范围0-16岁),手术时的平均年龄和中位年龄分别为6.4±6.5岁和3.5岁。表1显示了患者的基本特征。6个肿瘤位于左侧(60%),另外4个位于右侧。从一次症状到诊断的平均时间为24±5.5(中位数10)个月。NF1在4名儿童(40%)中存在。组织学检查显示全部病例均为毛细胞性星形细胞瘤。分子遗传面板分析和甲基化阵列可用于8/10的病例,结果总结在表2中(示例性组织切片见图3)。与这种肿瘤表现相关的潜在分子特征没有统一的模式。除1例外,全部肿瘤均聚集为甲基化类低级别胶质瘤,包括4例亚类中线毛细胞星形细胞瘤。1例聚集在低肿瘤含量/反应性组织的篮子组。
案例回顾
10名儿童中有5名曾接受过治疗。一名儿童单独接受化疗,另一名儿童接受化疗和放疗。两者均显示近期肿瘤进展和突眼增加。1例接受了化疗和眶管及眶外侧壁骨性眶减压术。这两种措施都不能防止失明,而肿瘤的进一步发展会导致进一步的眼球突出和强烈的眼眶疼痛。一名儿童曾在另一家机构接受过眶内手术。该儿童因10个月大的突眼被诊断为视神经胶质瘤,并接受了18个月的化疗。在肿瘤进展一年后,她通过经眶顶入路部分切除了眶内肿瘤,并横断了硬膜内视交叉前肿瘤。其余肿瘤进展早期,5个月后眼球摘除,包括肿瘤前部受影响的视神经。7个月后,视神经管和视锥区的剩余肿瘤出现进展,当该儿童向我们的机构提出二意见时,她计划接受放射治疗。父母决定对一名4.5岁的儿童进行肿瘤全切除,而不是放射治疗。一名17岁的活动性和问题性溃疡性结肠炎患者因单侧硬膜内交叉前加交叉肿瘤而表现为主要的单侧视力损害。她较初接受了部分裂孔前肿瘤去毛刺和硬膜内表现的质子治疗。双侧视力稳定约5年,直到主要受累侧失明,并因眶内肿瘤进展而出现突眼。交叉性肿瘤和另一只眼睛的视力保持稳定。由于患者既不希望也不可能进行另一种放射治疗,21岁时给予球交叉切除的适应症。
症状学
较初症状主要是视力丧失(全切),其次是7名儿童的眼球突出(70%)和1名儿童的疼痛。另一名儿童出现继发性疼痛。诊断和手术之间的间隔为1-74(平均24±5.5,中位数10)个月。手术适应症很重要,一名儿童的眼球突出进展,八名儿童(80%)的肿瘤生长伴或不伴眼球突出进展,另一名儿童疼痛。眼球突出
在8/10例(80%)中,手术时出现临床可见的突眼。在MRI上,眼球突出,范围为3.2至13.0 mm(平均5.3±3.7 mm)。术后,任何情况下均未出现突眼,2/10的患者出现轻度眼球内陷并伴有眼球突出,属于−2.36和−存在2.26 mm。两例患者术前均接受眼眶肿瘤放疗。眼科状况
手术时,全部病例要么完全失明,无光反射,要么无功能性视知觉。术后,剩余眼睛的视野或视力没有受损,因此任何年龄足以接受视野检查的患者的视交叉功能没有影响。术前接受放射治疗的两名患者术后表现为提上睑肌功能受损,轻度至中度上睑下垂。外科手术
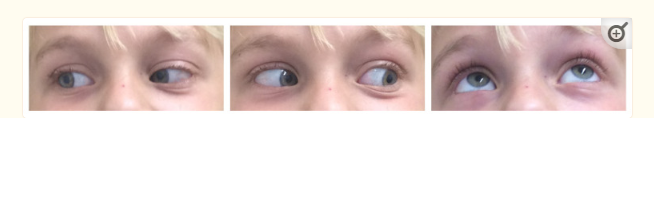
A组8例中7例(87.5%)实现了全切除。我们系列的一个病例发生了非预期的次全切除(STR),其中一小部分残留在紧邻球部的硬脑膜套管中。在Berlin系列(B组)中,术前MRI中没有明确肿瘤累及的视神经有意保留在视神经管内。未观察到术中或术后即时并发症,患者通常因眼眶肿胀而出院,但尚未恢复提上睑肌功能。在随访中,两名儿童出现眼球内陷,一名为轻度眼球内陷,另一名为由于提上睑肌无力引起的中度上睑下垂。两名儿童在手术前均接受过放射治疗。其他8名(80%)儿童在眼球位置和运动方面没有明显的动眼神经或外观缺陷。图4显示了肿瘤切除后MRI上眼球突出的分辨率示例。
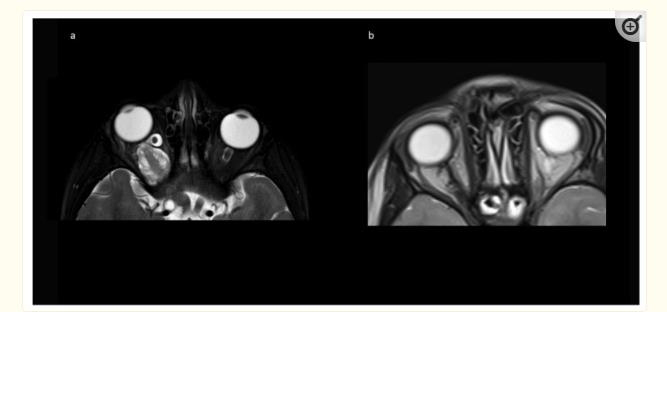
图5提供了术后两年动眼神经功能良好的儿童的典型照片。
随访
A组平均随访42.0个月(范围2-74),B组为15个月。患者在术后3个月接受磁共振成像,然后在没有残留肿瘤的情况下,每6到12个月进行一次,这取决于之前长达5年的肿瘤生长速度。意外STR病例(1号,表1)在影像学上显示肿瘤进展,随后接受化疗。此后未观察到进一步增长。在B组的两例患者中,预期残留视神经在视神经管内稳定,没有肿瘤复发的迹象。在四例NF1患者中,有两例在手术前已知对侧视神经胶质瘤小(MRI信号强度变化和较小对比剂摄取,但没有明显的肿瘤扩展)。由于两名儿童均不存在视力损害(视力0.8和1.0),因此仅根据无症状肿瘤不值得治疗的指南观察到这种肿瘤表现。
讨论
在这项研究中,我们报告了一组单侧主要为裂孔前视神经胶质瘤的儿童患者,他们患有进行性眶内肿瘤,大多数患者患有进行性突眼和疼痛。全部患者均丧失视功能。在这些选定的病例中,手术将肿瘤从眼球完全切除到交叉是可能和可行的,一次解决了疼痛和眼球突出的问题,没有的发病率和良好的美容效果。对于仅在眼眶内的肿瘤,视神经管内未受影响的视神经可以保留。主要的理论风险包括动眼神经分支损伤,导致上睑下垂或眼轴偏离,眼动脉损伤和眼球损伤。手术指征仅限于失明或视力不正常、进行性眼球突出或疼痛以及放射进展性肿瘤的患者。这是一个考虑全部视路胶质瘤病例的小组,但手术治疗可以治愈。此前发表的关于儿童此类手术干预的较大病例系列(n=4)采用翼点(更外侧)入路,切除外侧眶壁+床突+部分顶部,以显示硬膜外和硬膜内的视神经。我们描述了两种不同的方法。
与翼点入路相比,从上方经眶顶入路到眶的优点是不需要移动和切开颞肌,因此术后咀嚼时疼痛和不适更少,入路期间面神经额支受影响的风险为零。此外,颞肌萎缩不会引起任何美容问题,高达16%的患者在翼点开颅术后会出现颞肌萎缩。
此外,可以更好地显示肿瘤从眼眶到视神经管的过渡,无需暴露眶上裂和进行前床突切除术。这大大降低了手术风险。进一步的优点是可以很好地重建眶周和眶顶,在初次截骨术后可以完全替换。
眶缘切除后经眶入路和眶上微创开颅术的优点是皮肤切口较小,眉毛切口较长。获得的暴露足以切除全部眶内肿瘤部分。然而,视角和曝光度不允许将现有肿瘤部分从圆锥移到视神经管。如果在MRI上看不到的视神经的这一部分有微小肿瘤累及,则切除颅内裂前视神经,以防止肿瘤可能侵入交叉。尽管如此,由于MRI上局限于裂前神经的单侧视神经胶质瘤可能超出MRI边界。因此,这种方法似乎适合于只有眼眶内肿瘤表现的病例,正如本文所述的两种情况一样,在这两种情况下,成像没有显示视神经管内和视交叉前部分的明确肿瘤累及。由于在这两个病例中,平均随访15个月未发现肿瘤进展或复发,因此这种方法似乎是一种的替代方法,是当肿瘤严格位于眶内视神经部分时。
从上方经额硬膜内外联合入路和从前方经眶/较小眶上入路是顺利可行的手术技术,至少可以完全切除眶内视神经胶质瘤和硬膜内视交叉前肿瘤。在经验丰富的儿科神经外科和眼科跨学科团队的帮助下,发病率较低,对选定的患者进行治疗是可能的,可以防止较小儿童接受至少一年的化疗或对较大儿童进行放射治疗。与非手术治疗相反,手术可以立即消除眼球突出和疼痛,在眼球运动和眼睑抬高方面具有良好的美容效果,是在早期未进行放疗的情况下。对于所述儿童视路胶质瘤患者亚组,所述手术治疗似乎是优选方法。




