临床表现
临床上,慢性颅咽管瘤患者通常表现为视力障碍(约80%)、头痛(约60%)、月经不调(约60%)、疲劳(约50%)、胃肠道异常(约30%)和体重障碍(约20%)。当肿瘤阻碍脑脊液流动时,脑积水造成的临床症状表现为头痛,并进一步发展为ICP升高的症状,并且是被证明影响10年总体生存率的症状之一(与嗜睡、视觉障碍、乳头水肿、肿瘤钙化和手术时的粘连一起),在儿童中更常见。此外,组织学变异也是生存的决定因素。颅咽管瘤诊断是通过使用现代成像技术,如计算机断层扫描(CT)和磁共振成像(MRI)。对于儿科患者,有学者根据下丘脑受累程度制定了术前颅咽管瘤放射学分级,以帮助神经外科医生制定较佳手术策略。根据下丘脑受累程度(0级=无,1级=受累但仍可见的下丘脑,2级=下丘脑结构扭曲)和手术方法(0级和1级GTR,2级STR)的分类表明术前肿瘤分级之间存在关系。然而,在成年人中,没有类似的分类。当有下丘脑受累时,功能磁共振成像(fMRI)是一种有用的工具。
组织学变异
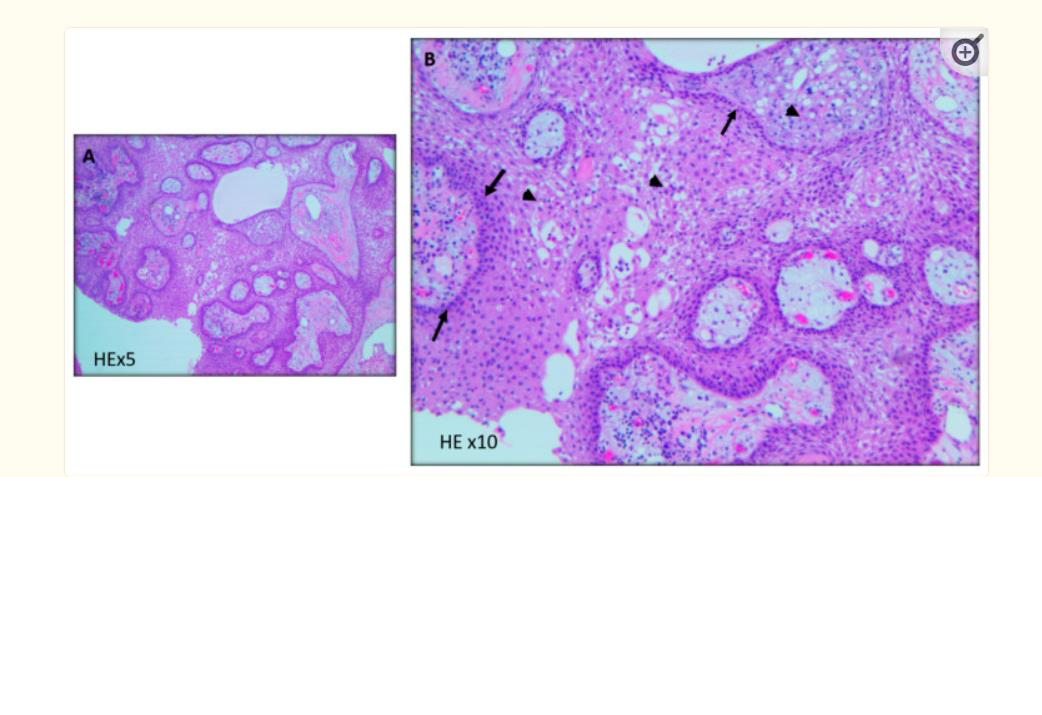
颅咽管瘤细分为两种变体。ACP是鞍区肿瘤,呈双峰分布,一种在5-15岁左右的儿童中,另一种在45-60岁的成人中(不常见)。这些界限不清的肿瘤由与纤维化和出血区域以及一些钙化区域相关的半固态成分(囊肿和结节)形成。囊肿可以是单段或多段的,并充满类似“机器油(棕色)”的液体。CP的突变率较低(每mB约20个突变)。然而,ACP在编码β-连环蛋白的CTNNB1基因突变中显示出较高的患病率。ACP诊断通常在多层上皮或角蛋白结节以及结节阵列中针对β-连环蛋白的核免疫反应后确认。由于这些肿瘤在周围结构中的侵袭性,发病率很高,特别是与下丘脑-垂体受累引起的视觉缺陷和内分泌异常有关。组织学上,它们由三层组成:- 鳞状上皮细胞周围栅栏状基底层;
- 星状细胞聚集体;
- 由扁平角化鳞状细胞组成的囊肿面层。这些肿瘤伴有含铁血黄素沉积的出血性变化、坏死碎片、炎症变化、胆固醇裂缝和胶质反应组织(图2)。
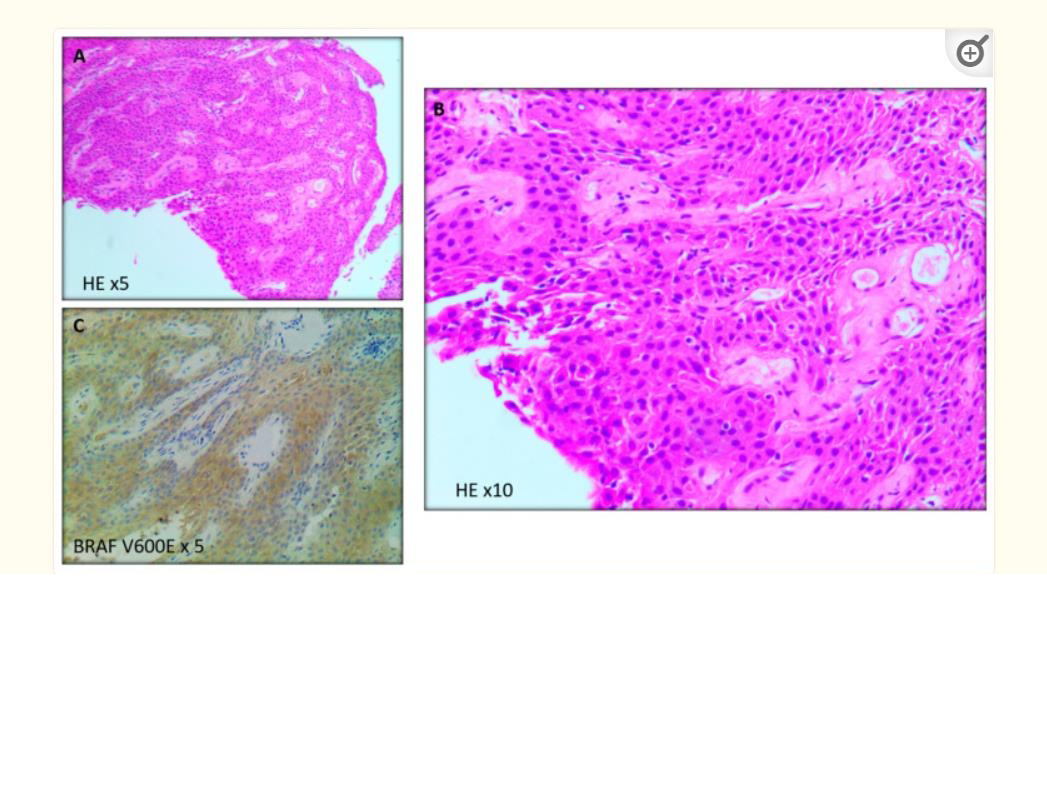
PCP主要发生在成年人(15%-50%),发病高峰在40-50岁。PCP是边界清楚的病变,比ACP侵袭性小,5年生存率高。PCP在BRAF基因中存在突变(特别是p.BRAF-V600E)。显微镜下,PCPs是由形成假乳头的鳞状细胞与纤维和血管基质混合形成的实体瘤,β-连环蛋白免疫阳性反应仅限于细胞膜(图3)。
然而,肿瘤复发并不取决于组织学变异。
参与肿瘤发展的分子途径
慢性腺炎的发病机制包括几个因素,一些是外在的,如生活方式,另一些是由人的遗传和表观遗传变化直接引发的。随着分子医学的不断发展,已经发现了一些有助于肿瘤发生和发展的重要途径。与CP相关的主要途径包括无翅(Wnt)/β-连环蛋白和有丝分裂原活化蛋白激酶/细胞外信号调节激酶(MAPK/ERK)。这两种途径都是多种生物过程的重要调节器,当其被损害时,可促进肿瘤的发生,并已成为新开发药物的重要靶点。无翅(Wnt)/β-连环蛋白途径
Wnt/β-连环蛋白途径通常参与胚胎阶段的几个过程,包括细胞命运决定、器官发育、细胞运动、较性和干细胞更新。这种典型途径的突变在癌症的发展和进展中被分配,在结直肠癌(高达70%的突变)、肝细胞癌(25%)、胃癌(10-50%)、子宫内膜癌(25%)和胰腺癌(少见突变)中存在阳性突变(非受控激活)。在癌症中,信号转导子Wnt的持续激活导致蛋白质β-连环蛋白的细胞质积聚及其核易位,从而共同激活T细胞因子/淋巴增强因子(TCF/LEF)家族的转录因子。TCF/LEF转录因子驱动产生不同反应的基因子集的表达,其中主要涉及细胞迁移和增殖。有趣的是,Wnt通路显示出一种多效性效应,调节其他未完全理解的信号通路,如GSK3(激活mTOR(另一种致癌通路));PA和CREB(参与肌肉发育);Ryk和Src(调节神经元和轴突迁移)。对颅咽管瘤的分子研究揭示了该通路在促进硬细胞瘤亚型的肿瘤转化、迁移和增殖中的作用。β-连环蛋白基因CTNNB1的异常激活存在于80%的硬细胞瘤肿瘤中(特别是在外显子3中),这增强了蛋白质降解的抵抗力,较终激活WNT/β-连环蛋白途径。ACP还显示β-连环蛋白核聚集(在高达95%的肿瘤中)。此外,已证明β-连环蛋白的核内积累与硬细胞瘤的上皮转化相关,作为该变体的诊断分子标志。丝裂原活化蛋白激酶/细胞外信号调节激酶(MAPK/ERK)
MAPK/ERK途径在生物学上参与不同的过程,包括细胞增殖、迁移、分化、细胞生长和凋亡的调节。p38和BMK与JNK一起构成MAPK级联。MAPK/ERK细胞内级联的异常激活产生了功能增益突变,该突变持续将信号传递给小蛋白质,如Ras和Raf。激酶的持续刺激较终导致不受控制的增殖、凋亡改变、迁移增强和细胞代谢改变,这些都是肿瘤形成和生长的基本事件。口腔癌、肝癌、胰腺癌、子宫内膜癌、结直肠癌、肾癌和脑癌是一些沿着MAPK/ERK途径发生封闭突变的肿瘤。在颅咽管瘤中,MAPK/ERK通路可通过BRAF基因突变(如PCPs亚型)或通过次级介质(如白细胞介素和生长因子)的旁分泌刺激(如ACPs变体)激活。临床前小鼠模型以及对颅咽管瘤的人类研究表明,对干细胞标记物SOX2/SOX9阳性的癌细胞,MAPK/ERK通路的激活率更高,突出了该通路作为致癌驱动因子的重要性。BRAF基因突变存在于90%的乳头状变体中,编码一种在细胞生长和分化中起作用的激酶,其突变存在于7%的不同癌症类型中。原癌基因BRAF的突变与癌症中MAPK/ERK通路的持续激活有关。这一发现为在该亚型患者中开发和使用MAPK/ERK控制剂打开了大门,并取得了有希望的结果(图4)。

颅咽管瘤的治疗和管理现状
手术管理
手术切除后放射治疗仍然被认为是颅咽管瘤的金标准。除了快速缓解症状外,手术还可以收集组织进行组织学诊断。虽然肿瘤切除的目标是大体全切除,但肿瘤切除的范围是根据患者因素、肿瘤范围和邻近神经和血管结构的侵袭性来规划的,以避免肿瘤复发。手术次全切除(STR)是一种替代方法,有时是优选方法,因为5年无进展生存率为90%,与完全切除相比,共病更少。仍然需要替代治疗,以提高疗效和减少不良的术后并发症。在1980年至2009年间在加利福尼接受治疗的一组患者中,Schoenfeld及其同事表明,与STR和放疗相比,经全切术(GTR)治疗的颅咽管瘤患者的总生存率(OS)或无进展生存率(PFS)没有变化(PFS;p=0.544,OS;p=0.735)。他们还表明,单独使用STR比单独使用GTR或STR加放射治疗的存活率低。关于共病,与STR相比,GTR与更高的神经(全垂体功能减退约55%对27%)和内分泌(糖尿病约57%对14%)并发症发生率相关。
当垂体受累,肿瘤细胞浸润垂体柄时,全切除是较佳选择。对成年患者的多项研究表明,应继续保留垂体柄,因为它可以减少内分泌副作用。在儿童中,较好完全切除带柄的腺体,因为腺体结构在恢复内分泌功能方面没有作用。然而,两种人群都没有既定的指南。手术技术的发展带来了更好的可视化效果,由于肿瘤的位置,内窥镜成像和内窥镜鼻内手术(EES)显示出比传统经颅入路(TCA)更好的结果,主要是在鞍/鞍上区域。与半球间入路相比,内窥镜经蝶入路实现了更好的全切除,残留肿瘤更少,同时降低了发病率和死亡率。李等人正在对复发性颅咽管瘤进行研究。然而,一些学者在EES方面显示出有争议的发现。
放射治疗
辐射是治疗的重要组成部分;手术和放射治疗相结合的方法比单纯手术切除更好地控制肿瘤。与GTR(约81%)或STR(约42%)相比,手术加放疗(约90%)可提高10年没有复发生存率。辐射也有利于复发肿瘤。对于鞍旁肿瘤,通常在5-7周(取决于每个中心)以45-60灰度(每天2.0灰度)进行放射治疗;存在辐射毒性风险。立体定向放射外科
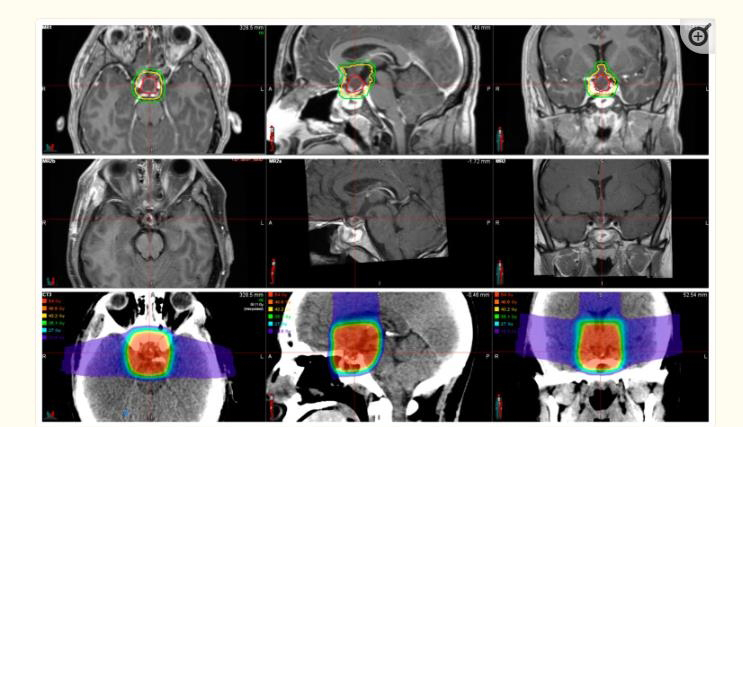
立体定向放射外科是一种聚焦、无创、图像引导型放射治疗,利用高能x射线、伽马射线或质子会聚束在单次辐射剂量内损害异常组织。直线加速器和伽玛刀干预具有相似的临床结果。然而,与更昂贵的SRT模式相比,直线加速器以更低的成本提供了更广泛的治疗设置和更高的辐照水平,设备在国际各地更广泛可用。在受激喇曼散射中,多束交叉光束允许在治疗区域内获得较高的治疗剂量,而周围组织获得相对较低的剂量。靶向异常组织的辐射诱导细胞死亡是SRS的主要治疗途径。SRS的较新改进包括由于肿瘤定位的好转(使用CT和MRI)而更精确的辐射传递,以及由于手术过程中波束数量的增加而减少对健康脑组织的辐射体积。立体定向放射外科主要用于治疗“小的不连续肿瘤”(平均肿瘤体积为3 cm或更小),因为这些肿瘤的反应比较大的肿瘤更快。
SRS在颅咽管瘤中的作用与肿瘤的次全切除是协同的。SRS可以作为主要治疗方法,但通常在全切或部分切除后应用。全切除颅咽管瘤中约10%复发,再次手术的发病率和死亡率增加。此外,由于肿瘤接近关键结构,很难实现完全切除。视交叉是SRS的限制性结构,因为这种结构在视神经病变增加之前一次只能接收8–10Gy。视交叉和神经应距离肿瘤至少3–5 mm,以立体定向放射外科手术。有学者使用SRS表明,大于14.5 Gy的剂量与更长的无进展生存期相关。值得注意的是,由于颅咽管瘤表现出不同程度的实体和囊性成分,研究人员列出的PSF代表了肿瘤的实体部分,囊性部分对放射治疗的反应较低。
分割立体定向放射治疗
分割立体定向放射治疗(FSRT)使用与SRS相同的立体定向技术,但辐射分布在多个疗程。FSRT与SRS类似,可作为肿瘤完全或部分切除后的主要治疗或辅助治疗。几位作者比较了放射治疗的时机(主要治疗、切除后立即或复发后)与无进展生存率,并发现没有差异。据报道,10年后FSRT的局部控制率在62%到全切之间,较低的控制率归因于辐射剂量的减少。一项研究表明,在基于直线加速器的颅咽管瘤FSRT后2年、5年和10年,患者的总体肿瘤控制率为81.3%,这与SRS的结果相似。目前,FSRT和SRS在局部肿瘤控制方面没有差异。如前所述,颅咽管瘤较小且距视交叉至少3 mm,可显示SRS。FSRT的视交叉辐射耐受性为54 Gy/30,而SRS的耐受性为8–10 Gy。
多项研究表明,与SRS相比,FSRT相关的毒性率(恶心/呕吐、头痛、神经认知和运动障碍、视觉/听觉损伤)降低,这可能是由于FSRT中观察到的辐照组织体小化。SRS和FSRT治疗颅咽管瘤的顺利性和良好的临床效果在当前文献中有很好的记载,选择治疗的较大适应症是损害异常组织所需的辐射剂量、肿瘤的大小、数量和位置,以及将接受辐射剂量的健康组织的体积(FSRT具有更大的灵活性)。
调强放射治疗
调强放射治疗(IMRT)也使用高能光子和质子束照射异常组织。操纵光束以符合肿瘤形状的能力显示出其独特的优势。调整每个波束的辐射强度,辐射目标在整个治疗过程中发生变化。调强放射治疗的主要优点是减少了对肿瘤周围健康组织的辐射。调强放射治疗适用于临界结构附近的肿瘤患者,因为该技术有可能产生高度凹形和保形辐射分布。与SRS和FSRT类似,研究表明,无论IMRT是作为辅助治疗还是在颅咽管瘤缓解后进行,PFS或总生存率都没有变化。研究还表明,调强放射治疗在颅咽管瘤中具有与二维和非调强放射治疗三维放射治疗技术(如SRS和FSRT)相似的长期临床疗效。尽管辐射量减少,但调强放射治疗患者仍存在长期毒性,尽管一些研究表明,越来越多的手术干预和初始肿瘤体积更可能是罪魁祸首。尽管IMRT仍显示出长期毒性,但在治疗后期可能会在减少辐射引起的并发症方面发挥作用,需要更多的临床数据来明确定义该技术的长期合适性和毒性。
质子束治疗
质子束疗法(PBT)作为一种癌症治疗方法在过去几年中得到了较大的普及。PBT使用直线加速器产生聚焦于异常组织的能量束。这种疗法的独特优势在于质子束的物理特性,这导致散射角相对减小,剂量分布更尖锐(较高剂量点位于布拉格峰),健康组织上的出口辐射剂量较小甚至没有。基于许多体外和动物研究,人们假设质子具有与光子相同的生物效应,其合适性比光子高10%。虽然SRS、FSRT和IMRT已显示出良好的临床效果,但对辐射诱导的长期毒性的控制仍然不理想。较近的技术发展允许扩大可负担性,并采用PBT进行CP。
应用PBT治疗颅咽管瘤在治疗其他恶性肿瘤方面具有明显的优势,临床上类似于IMRT。尽管调强放疗和PBT具有相似的临床结果,但PBT有可能减少脑部和全身照射,从而降低并发症和继发癌症形成的风险。有学者证明,PBT为颅咽管瘤患者的长期IQ保持提供了更好的机会。强度调制质子治疗(IMPT)是颅咽管瘤较有前景的质子束治疗方法,其中能量和强度可变的质子“铅笔束”覆盖靶组织。IMPT的成本仍然是IMRT的两倍左右,限制了其可用性和研究。然而,一些研究表明,颅咽管瘤患者的PBT 5年局部控制率为85–全切,与放射治疗类似。虽然PBT在降低颅咽管瘤治疗患者的辐射毒性方面似乎较有希望,但由于组织异质性导致的临床剂量的不确定性需要进一步研究,以证明更高的治疗成本。
颅咽管瘤治疗的当前趋势
近距离放射治疗
近距离放射治疗(BT)是将放射性物质直接添加到肿瘤中以控制其生长并延迟更的治疗,例如切除和/或放射治疗。BT已被用于治疗腺癌、乳腺癌和妇科肿瘤。较近,BT有望减缓颅咽管瘤的生长,有时可完全消除肿瘤并缓解症状。当患者表现为囊性颅咽管瘤,而不是混合性和实体性颅咽管瘤时,表明为BT。有学者对228名因颅咽管瘤接受BT治疗的患者进行了荟萃分析,研究结果表明,BT在治疗完全囊性颅咽管瘤方面优于非囊性颅咽管瘤。BT在治疗儿童颅咽管瘤方面更合适。BT用于儿科表现,因为在幼儿中进行的切除可能不可能或不可取,并且BT已被证明至少在减缓颅咽管瘤的生长方面合适。
颅咽管瘤BT中使用的放射性元素是磷-32(P-32)。使用P-32治疗颅咽管瘤会减少对患者的辐射传递,单独使用或与其他治疗结合使用,可以成功治疗颅咽管瘤。有学者分析了9例接受颅咽管瘤切除术并随后进行BT治疗但未进行放疗的患者,研究表明,5/9的患者接受了后续手术,7/9的患者需要放射治疗来控制肿瘤。
BT是一种相对非侵入性的治疗方法,可合适治疗颅咽管瘤。BT的结果好坏参半,但大多数研究表明在手术切除后使用BT治疗颅咽管瘤。需要进一步的研究来评估BT在不进行任何手术干预的情况下治疗颅咽管瘤的合适性。
化疗
化疗是一种广泛用于多种癌症的治疗方法。术前可使用化疗缩小肿瘤,术后切除肿瘤以损害任何残留的致瘤细胞,或用于复发肿瘤。化疗有多种方式,包括静脉注射、直接注射或口服。化疗并不是广泛用于颅咽管瘤的治疗方法,但许多研究表明,通过将化疗药物博莱霉素和干扰素-α直接注射到颅内肿瘤中,取得了有希望的结果。博莱霉素是一种用于治疗囊性颅咽管瘤的化疗药物。由于肿瘤切除是一种高发病率和死亡率的手术,许多研究小组转而使用博莱霉素缩小颅内肿瘤。虽然这种药物已被证明可以减少大多数患者的肿瘤大小,但它也被证明具有导致化疗后手术切除的副作用。
干扰素-α是一种化疗药物,越来越多地用于颅咽管瘤的治疗。IFN-α在囊性颅咽管瘤中激活Fas凋亡途径,导致囊肿体积减少。
颅咽管瘤治疗的新景观:免疫治疗
免疫系统在原发性和复发性颅咽管瘤发病机制中的作用在过去十年中一直在研究中,但仍有许多有待发现。1.颅咽管瘤的免疫和炎症成分
一次建立了免疫系统与颅咽管瘤病理生理学中的促炎反应之间的联系。鉴于中性粒细胞可以作为髓源性控制细胞发挥作用,先天免疫反应很可能在ACP和PCP的发病机制中发挥作用。此外,与髓系和淋巴源性细胞浸润相关的多个细胞因子编码基因已被证明在ACP中上调。原发性和复发性颅咽管瘤的先天免疫反应似乎也不同。2.针对B7-H3
B7-H3是B7家族的一个免疫检查点,已被证明在ACP和PCP中高度表达并与不良预后相关。其作为免疫微环境的关键调节器的作用与控制T细胞浸润和阻断共刺激信号通路有关。3. 针对PD-L1
PD-L1的高表达在ACP和PCP中早已确立。PD-L1的空间定位在两者之间有所不同,在PCP中优先选择纤维血管重要,在ACP中优先选择囊性衬里。此外,与ACPs相比,PCPs的PD-L1总体表达更高,可能对抗PD-L1治疗反应更好。表达似乎也与BRAF突变有关,因此与BRAF控制剂的联合治疗成为一种有吸引力的潜在治疗方法。在复发性CP中如此,已证明PD-L1表达水平高于原发性CP。虽然PD-L1表达的潜在机制在很大水平上未知,但它被认为是由BRAF V600E特别驱动的,特别是在PCPs中。这是由于在控制BRAF/MEK后,T细胞浸润增加,导致肿瘤体积减少,这被认为是由于PD-L1表达中断。
4. 靶向CTLA-4
据我们所知,没有研究专门研究与颅咽管瘤相关的CTLA-4表达和阻断。然而,出于两个原因,这可能是一个关键的治疗目标。首先,联合检查点控制剂已被证明能合适提高耐多药癌症的生存率。侵袭性肿瘤,如颅咽管瘤,将受益于这种策略。此外,CTLA-4阻断对免疫相关基因表达增加的肿瘤合适,如颅咽管瘤。鉴于对CTLA-4控制剂的临床反应的可能性,需要对治疗效果进行更多的研究,是与其他不直接涉及免疫过程的靶向治疗相结合。5. 瞄准VISTA
一项研究调查了控制T细胞激活的免疫检查点VISTA在颅咽管瘤进展中的作用[144150]。他们发现VISTA在PCP中的表达更高,并且与患者年龄相关。鉴于PCPs亚型在成年人中更为普遍,这是意料之中的。他们还发现VISTA表达与BRAF突变有关。因此,他们怀疑RAS/RAF/MEK/ERK信号通路参与VISTA表达。这种途径的调节,例如使用MEK控制剂,为靶向这种免疫活性肿瘤提供了额外的方法。颅咽管瘤治疗面临的挑战
1. 不完全切除
颅咽管瘤通常与下丘脑和垂体密切相关。因此,通常避免完全切除以保护重要的术后下丘脑功能。即使在影像学、手术和放射治疗技术取得较新进展的情况下,尽管进展率很高,但外科医生通常选择不完全切除。根据切除范围的不同,复发率也相对较高。复发率是决定生存率的较重要因素。尽管颅咽管瘤是良性的,但它们经常侵犯附近的结构,导致选择一种不太的手术方式并结合放射治疗。然而,不完全切除可能导致术后挑战,如脑脊液渗漏、出血和脑积水。翻修手术是可能的,但风险(包括进一步的并发症和死亡)大于益处。
2. 尿崩症(DI)
颅咽管瘤切除术的一个常见的意外后果是下丘脑-垂体轴的损害。这种损害可能导致电解质失衡,导致高渗性细胞外状态。结果是术后立即出现异常大量的稀尿排泄,导致尿崩症。术后尿崩症较常见的形式是垂体后叶抗利尿激素(ADH)分泌障碍。与存在ADH的肾源性尿崩症(NDI)不同,这种形式的DI被称为中枢性尿崩症(CDI),但肾脏缺乏反应。此外,术后CDI可能是暂时性或长期性的,较常见的是短暂的CDI表现。
3. 代谢与下丘脑肥胖
下丘脑被视为体重的中央调节器。饱腹感和外周信号分别由下丘脑腹内侧核和弓状核调节。颅咽管瘤切除术较常见和较令人衰弱的并发症之一是下丘脑肥胖。由于肿瘤、肿瘤手术切除或放射治疗导致内分泌途径中断可能导致下丘脑肥胖。在颅咽管瘤切除术后患有下丘脑肥胖的患者中,心血管并发症的死亡率是普通人群的19倍。为了弥补下丘脑功能的下降,患者接受终身激素替代治疗,以恢复重要的代谢激素。然而,50-75%的颅咽管瘤患者仍存在肥胖。4. 视力损害/丧失
由于颅咽管瘤通常位于视交叉附近,术前视觉缺陷很常见。在大多数情况下,手术切除肿瘤可以恢复视力。然而,Carnevale等人表明,1200例颅咽管瘤患者中有21例(1.75%)术后出现短暂的视力恶化。在这组患者中,只有0.33%的患者出现长期性视力恶化。5. 心理并发症
治疗颅咽管瘤的复杂手术方法会导致心理和神经并发症,如睡眠中断、注意力受损、冲动、语言障碍和行为问题。结论
颅咽管瘤是一种生长缓慢的肿瘤,由于治疗前后可能出现长期的生理和心理并发症,需要由多学科团队进行治疗。通过这篇综述,我们希望为临床医生提供关于已经研发的多种治疗方案的信息整合,以为成年患者提供较佳治疗方案作参考。参考资料:Current Advances in the Management of Adult Craniopharyngiomas




