中枢神经细胞瘤(CN)是一种好发于年轻成人的脑室内肿瘤。其临床病程通常较好,10年总生存率超过80%。在组织学定义的CN队列中,手术切除程度(EOR)是最重要的预后因素,患者从肿瘤全切术(GTR)中获益最大。然而,即使完全手术切除后CN也可能复发,且有报道称部分病例可出现恶性行为伴颅脊播散。目前CN被归类为CNS WHO 2级肿瘤。
根据2021年最新WHO中枢神经系统肿瘤分类,CN仅凭组织病理学即可确诊。多项研究显示,非典型组织学特征(如活跃的有丝分裂活性、血管增殖、坏死)和/或Ki67增殖指数>2-4%提示肿瘤侵袭性增强。2021年WHO分类将甲基化谱分析列为某些肿瘤诊断与分级的理想和/或必需标准,需结合组织病理学特征。
基于组织学队列的分子再评估显示误诊率高达12%,这促使预后评估方案需进一步完善。例如,DNA甲基化分析提高了形态学类似室管膜瘤肿瘤的诊断准确性,并能实现更佳的风险分层,而基于组织学的WHO CNS分级在表观遗传定义的室管膜瘤类别中失去预后意义。
CN的标准治疗方案是GTR(如可行)。对于接受次全切除术(STR)的患者,无论组织病理学或免疫组化结果如何,通常建议行辅助放疗(aRT)。尽管Ki67增殖指数升高尚无特定临界值,但2021年WHO分类指出对具有“较高Ki67(MIB1)指数”和/或非典型特征的患者应考虑aRT。另一方面,化疗仅在少数病例中研究过,其疗效及最佳药物组合仍不明确。
中枢神经细胞瘤预后研究
INC国际神经外科医生集团旗下组织世界神经外科顾问团(WANG)成员、世界立体定向与功能神经外科学会前主席Joachim K.Krauss教授等发表研究《Outcome-associated factors in a molecularly defined cohort of central neurocytoma》,研究中评估了与患者预后相关的因素,并探索了CN的表观遗传学特征。结果还提示较低年龄和STR(与GTR相比)是显著不良预后因素,而接受STR的患者在aRT后结局改善。此外,本CN队列中FGFR3的持续上调提示了放疗以外替代治疗策略的潜在途径。


研究对136例组织学分类为CN的肿瘤进行了全基因组DNA甲基化分析,评估了93/90例的临床/组织病理学特征,并对12例进行全外显子测序。将临床和分子特征整合入生存模型以预测无进展生存期(PFS)。136例中有125例(92%)经表观遗传学确认CN诊断。未发现DNA甲基化亚组,但全局DNA低甲基化成为CN的特征性标志,且与较高复发风险相关。
1.97%的病例观察到FGFR3基因体低甲基化伴FGFR3蛋白表达升高。
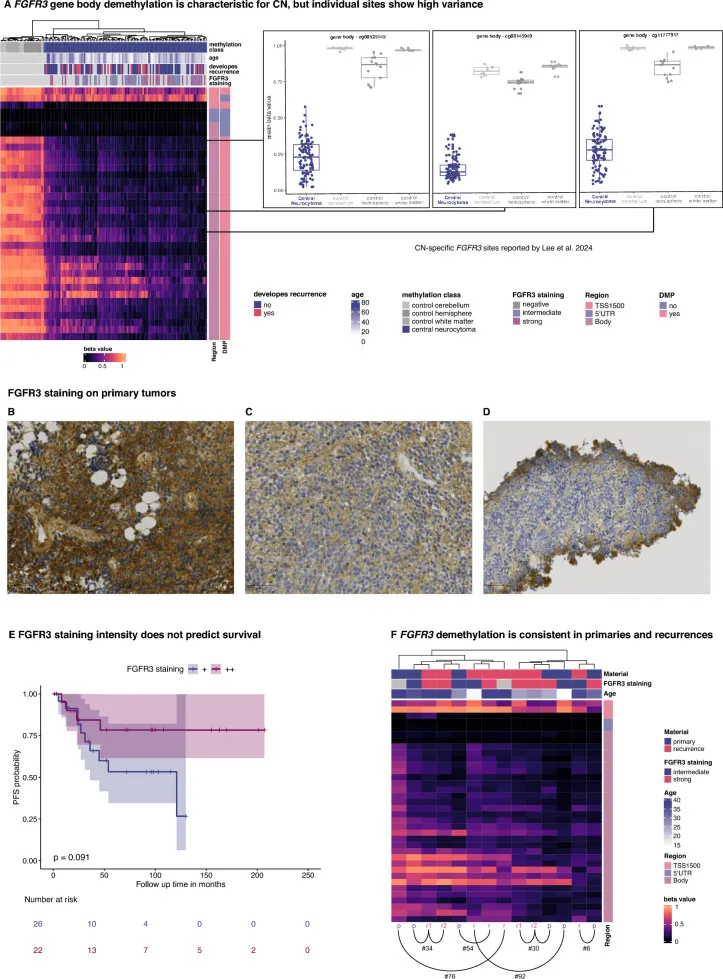
FGFR3基因体低甲基化与FGFR3过表达是中枢神经细胞瘤(CN)的特征性表现。
A对原发肿瘤及Capper等人2018年研究中对照组织的FGFR3基因座甲基化值进行聚类分析显示,基因体严重低甲基化是CN的显著特征。然而,个别FGFR3 CpG位点(特别是Lee等人2024年研究中指出的三个CN特异性位点)表现出高度变异。FGFR3甲基化水平与FGFR3染色强度无对应关系。
B-C FGFR3染色强度分布为:30/71例(42%)呈强阳性,41/71例(58%)呈中度阳性。
D免疫组化染色常呈现梯度效应,因组织固定假象,周边区域染色强度较高,向中央逐渐减弱。
E Kaplan-Meier生存分析显示,强阳性(++)与中度阳性(+)染色强度病例间的无进展生存期(PFS)无显著差异。
F FGFR3低甲基化在原发与复发样本中表现一致,且与样本材质、复发进展或患者年龄无显著关联。
2.与STR相比,肿瘤全切术(GTR)与PFS显著改善相关,而接受STR后放疗的患者结局更好(p=0.0001)。年轻患者复发风险更高(p=0.026)。
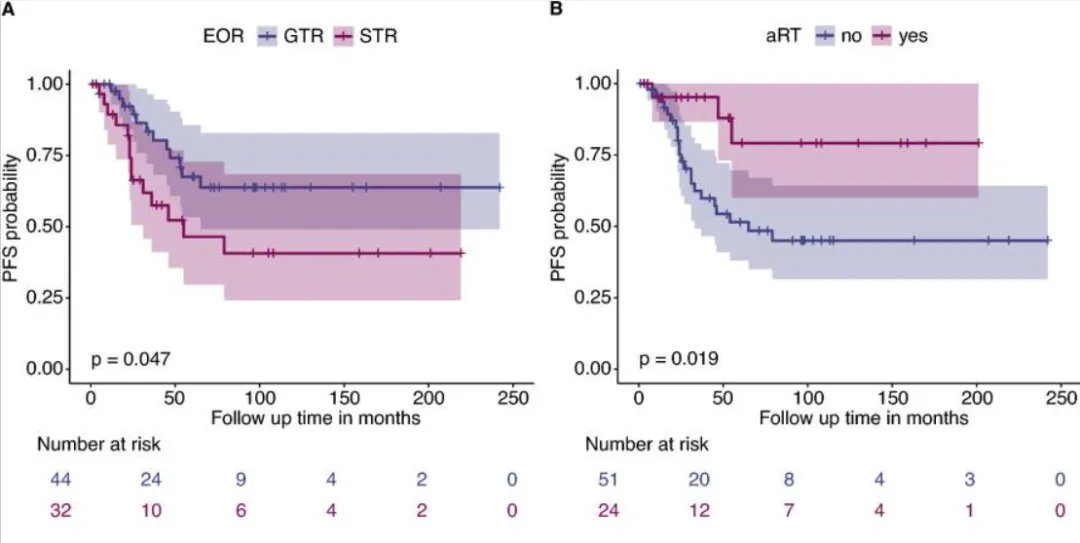
图A、B显示,切除率研究中,全切除无进展生存期高于次全切;辅助放疗相比辅助放疗,预后更好。
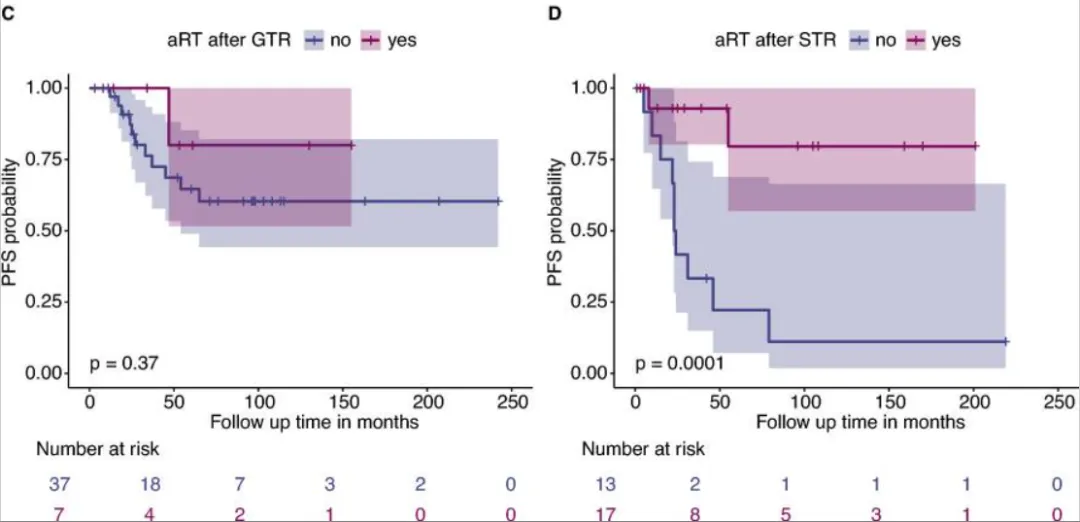
图C、D显示,辅助放疗的优势仅限于次全切除患者,对GTR患者的PFS没有显着影响。
患者年龄和治疗策略是该队列生存预后的关键因素。这些发现强调需对年轻患者加强随访,并对次全切除的患者进行辅助放疗。此外,FGFR3作为特征性标志和潜在治疗靶点,值得进一步研究。
结论
中枢神经细胞瘤是神经系统少见但很重要的疾病。由于它们与脑室系统的关系密切,使它很容易与其他疾病混淆。中枢神经细胞瘤完全切除后预后良好的特点,鼓励术者追求更积极的手术方法。




