Ki67是一种存在于细胞核中的蛋白,Ki是源于发现它的城市是德国基尔市(Kiel),67这个数字来源于实验编号。有研究人员发现这个蛋白的数量和细胞的分裂周期有紧密的联系。

人体的细胞分裂周期分为G1,S,G2和M期,当M期,即有丝分裂期结束后,一部分细胞就会进入G0期,即静止期,暂时不再分裂增殖。在正常组织中,绝大部分细胞处于这个状态。Ki67在细胞分裂的G1,S,G2和M期都是表达的,但是M期结束后,Ki67就会很快降解,G0期的细胞就不表达Ki67。
因此,Ki67就成为判断肿瘤细胞活跃程度的一个重要的指标。
Ki67指数的意义
病理报告(即活检后免疫组化结果)上都会有ki67这一项。ki67通常用百分数表示,范围在0%-全切之间。临床医生知道这是判断肿瘤恶性程度的,但往往并不明白其中的缘由。肿瘤的较大特点是生长失控。很多人误认为肿瘤的生长失控是由于细胞分裂加快、细胞周期缩短的结果。但实际上肿瘤细胞的分裂减慢,细胞周期甚至比正常的细胞周期长,只是处于增殖期的细胞数量增多了,肿瘤才生长迅速,超越了周围的组织。
在正常组织中,绝大部分细胞处于非增殖状态,细胞学上称为G0期。要构建良好的组织结构并执行特定的功能,需依靠这些增殖周期外的G0期细胞。打个比喻,G0期的细胞就像工蜂、工蚁一样。那些增殖的细胞就像蜂后、蚁后一般。当工蜂、工蚁的比例减少时,劳动效率必然会下降,导致组织结构不良。而处于增殖状态的细胞是难以执行特定功能的,也就是常说的没有分化。病理医生常看到肿瘤的死亡细胞增多。按照新说法,这可能迫使更多的周围细胞进入增殖周期,G0期细胞的比例减少,从而导致肿瘤组织的结构紊乱,病理学上称之为分化差。
多年以来,病理医生常用细胞的有丝分裂像作为判断肿瘤增殖速度、恶性度的指标。但在实际应用中这一指标的使用受到很大的限制。免疫组织化学解决了这一问题。Ki67单克隆抗体是在位于德国Kiel市的一所大学建立而得名。Ki67免疫组化染色可将大部分G0期以外的细胞标记,因而也被称为细胞的增殖指数。Ki67的阳性率越高,说明处于增殖周期的细胞比例越高,肿瘤生长越快;而G0期细胞自然就越少,组织分化越差。
有意思的是,Ki67的阳性比例常与细胞死亡的频度成正比。那么是细胞增殖多导致了死亡多,还是细胞死亡多导致了增殖多呢?如果是前者,应该是细胞死亡越多,则患者预后越好。但事实是,细胞死亡越多,患者的生存期常越短。所以,死亡增多导致增殖增加的推测更为合理。这样看来,Ki67是一个预后不好的标记。但话分两头说。对肿瘤化疗敏感的常是处于细胞增殖周期的细胞,那些G0期的细胞一般对化疗没有什么反应。所以,Ki67比例高的肿瘤往往对化疗敏感,化疗效果好。简单地说,Ki67标记的是处于增殖周期中的细胞。该标记阳性率越高,肿瘤生长越快,组织分化越差,对化疗也越敏感。一般来说,预后较差。
简单来说Ki67有三个作用:
1、判断肿瘤恶性程度
2、评估患者预后
3、判断患者化疗是否敏感

1、判断肿瘤恶性程度 Cancer malignant?and Invasive
通俗的说,Ki67的值越高,肿瘤就越恶性,侵袭性越强。那到底是为什么呢?
很多人都误以为,肿瘤的生长,是由于细胞分裂的更快,细胞的周期变得更短而造成的。殊不知大错特错!
实际上,
1. 癌细胞的分裂反而减慢了
2. 细胞周期甚至比正常的细胞周期更长了
那为什么肿瘤能够生长迅速呢?
那是因为,处于生长期的肿瘤细胞数量,明显的增多了,越来越多的肿瘤细胞处于生长期,当然肿瘤就发展迅速,超越了周围的正常组织了。

处于蓝色部分阶段的细胞,就处于生长期,会被标记到Ki67的阳性率里面。阳性率高,说明越多的细胞处于这个生长期。
在正常组织中,绝大部分细胞处于G0期,即非生长状态。
Ki67标记的是处于生长周期中的细胞,Ki67的阳性率越高,说明处于生长期的肿瘤细胞比例越高,肿瘤生长越快。
打个比方,一个人的Ki67+(30%), 就代表活检中取的全部恶性组织中的细胞,有30%的细胞都处于生长状态。这个比例越高,当然肿瘤就生长越快。
2、评估患者预后Cancer Prognosis Assessment
Ki67已经被标记为存活率的独自预后因子,且无论肿瘤是什么分期(早期,晚期等)与分型(肿瘤的子类型)。
有意思的是,Ki67的阳性比例,经常与细胞的死亡频度成正比。也就是,Ki67阳性率越高,细胞死亡越多。
但事实上,细胞死亡越多,患者的生存期越短。
原因是:Ki67阳性率越高,细胞死亡越多;细胞死亡越多,就迫使周围细胞不断进入生长期;进入生长期的细胞越来越多,导致肿瘤生长越来越快。所以Ki67阳性率越高,通常存活率越差。
3、判断患者化疗是否敏感Sensitivity to chemotherapy
这个就有点儿让人百思不得其解了,Ki67不是数字越高越不好吗?
任何事情都有两面性,通常对化疗敏感的都是处于细胞生长周期的细胞(二幅图的S,G2和M期的细胞),而G0期的细胞一般对化疗没什么反应。
所以,Ki67阳性率高的肿瘤,往往对化疗更加敏感,化疗效果会好。
较后,大家可以参考下欧洲人套细胞淋巴瘤患者的存活率统计。
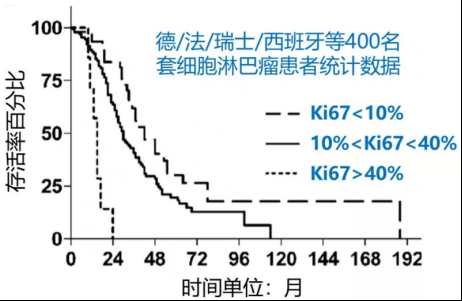
注:癌症的预后应该综合判断多个因素,这里仅仅把Ki67作为独自预后因素来考虑
那么,是不是Ki67值越高,就说明预后越不好呢?
不同类型肿瘤中,高Ki67值的具体意义不同
1、胶质瘤
脑胶质瘤是中枢神经系统常见的肿瘤之一,是较常见的原发性颅内肿瘤,胶质瘤占脑实质肿瘤的39%~45%,其主要特征是侵袭性生长,术后复发快,病死率高,因此各种治疗方法都不尽满意。按照国际卫生组织神经系统肿瘤分类(2007)标准将脑胶质瘤分为Ⅰ~Ⅳ级.胶质瘤的发病机制目前还不清楚,可能是机体内部遗传因素和外部环境相互作用的结果。Ki67是细胞增生核抗原,其表达水平能客观地反映肿瘤细胞的增殖活性和恶性程度,研究表明Ki67的表达与多种恶性肿瘤的发展,转移和预后有密切关系。Smith应用免疫组织化学方法检测发现,在正常脑组织中Ki67几乎不表达,在胶质瘤组织中有明确表达。Ki67在不同级别胶质瘤中均呈阳性表达,且从低级别到高级别呈上升趋势,Ⅲ、Ⅳ级胶质瘤中Ki67LI明显高于Ⅰ﹑Ⅱ级,这一结果与诸多文献报道的实验结果一致。说明Ki67能够作为判断胶质瘤的良恶性的重要指标。

表1:H3K27M、Ki-67蛋白高标记指数在脑胶质瘤组织中的表达例
此外,Ki-67与肿瘤大小也有关系。肿瘤大小除与肿瘤恶性程度、增殖潜能有关外,还与病程有关。有研究显示病人的中位病程时间为2个月 (病程时间按体检 发现肿瘤或出现症状就诊开始计算),当肿瘤位于非功能区且未引起明显颅内高压症状时,病人往往未曾察觉,这就导致无法准确获取病程时间。但Ki-67指数高的肿瘤,往往生长速度更快,可在短时间内压迫周围脑组织,引起颅内高压,导致症状出现,病程可短于 Ki-67 指数低者。研究指出:肿瘤级别越高, 较大径越大,体积越大。
一项关于“Ki-67是胶质瘤中有价值的预后因素”的综述分析,共纳入51项研究,涉及4307名患者。结果显示,Ki-67高表达可评估OS较差(HR=1.66, 95%CI: 1.53-1.80;Z = 11.87;p=0.000),PFS较差(HR=1.67,95% CI:1.47-1.91;Z = 7.67p=0.000)。亚组分析也显示,无论区域、病理类型、截断值和统计学方法如何,胶质瘤患者Ki-67表达水平高与OS和PFS较差有关。目前的meta分析显示Ki-67的表达可能是胶质瘤患者预后不良的评估因素。

因此,Ki67高表达提示肿瘤细胞增殖活性强,侵袭性高,从而导致胶质瘤易复发及恶变,说明Ki67的表达是一个重要的预后判断因素。
2、垂体瘤
国际卫生组织较近发布了2017年垂体腺瘤分类。他们强调,Ki-67指数高的垂体腺瘤(>3%)可能与肿瘤进袭性行为有关。使用识别细胞周期特异性抗原Ki-67的MIB-1单克隆抗体的MIB-1标记指数,与增长的生长速度和侵袭性生长相关。虽然大多数垂体腺瘤(PAs)被认为是良性肿瘤,但人们已经努力建立单个肿瘤的临床行为,重点是评估那些可能表现得更具有进袭性的肿瘤。在这里,国际卫生组织建议定义垂体腺瘤(PAs): Ki-67标记指数高、复发频繁、对常规治疗或替莫唑胺耐药、生长迅速、侵袭颈内动脉海绵窦段。Knosp分型对接近颈内动脉海绵窦段的肿瘤进行了分类,从而用来量化其对海绵窦的侵袭程度。3级和4级垂体肿瘤被认为具有侵袭性。对海绵窦的侵袭是不完全切除较常见的原因,导致复发率较高。因此,高Knosp级(>3)垂体肿瘤有很高的复发风险。在本研究中,Knosp分级为0、1、2级的为低级别侵袭性垂体腺瘤,分级为3、4级的为高级别侵袭性腺瘤。本研究旨在探讨垂体腺瘤Ki-67标记指数与Knosp分级之间的关系。
垂体瘤的分类经常更新,以基于当前的知识优化指导临床治疗。迄今为止,国际卫生组织定期举行专家审查共识会议,并公布结果。这些建议中包括更具进袭击性(aggressive)的行为,高Ki-67指数(>3%)垂体。高Knosp分级(>3)与高复发风险相关。Ki-67的表达水平与性别、年龄无相关性。
Ki-67在国际卫生组织垂体腺瘤分类中被认为是进袭性肿瘤行为的生物标志物。在垂体腺瘤中,增殖率的增加似乎与更具进袭性的行为有关,而在非侵袭性肿瘤中观察到低的增殖率。一些研究关注p53和Ki-67标记物同时表达与垂体腺瘤侵袭性和进袭性以及肿瘤进展和/或复发的关系。Thapar等报道分泌激素腺瘤的Ki-67平均标记指数(3.25%)高于无功能腺瘤(2.06%)。其他关注泌乳素瘤的病例系列研究表明,Ki-67指数越高,泌乳素水平越高,巨泌乳素瘤越大。
3、肺癌
肺癌是癌症相关死亡的较常见原因,其中非小细胞肺癌(NSCLC)占大多数。在诊断出肺癌后,男性的总体生存率低于女性。许多研究都集中在雌激素的作用上,以解释女性较高的存活率,但很少有人关注雄激素的作用。
有研究显示,雄激素受体AR表达与预后并非独自相关,Ki67也与死亡和复发的风险比升高相关(HR 2.19, 95% CI 1.30-3.70;HR 1.92, 95% CI 1.07-3.46)。AR表达改变了Ki67对预后的影响,因此当两者都表达时,与复发或生存无关(AR- Ki67+的HR 2.39, 95% CI 1.31-4.36 vs AR+Ki67+的HR 1.54, 95% CI 0.44-5.37)。Ki67只与较差的结果有关。单纯AR状态与预后无关。尽管机制尚不清楚,AR状态似乎否定了Ki67高和预后差的关联。
另有研究表明,ki67表达与肺癌分化程度、淋巴结转移有关。而ki67高表达组2年无瘤生存率(44.72%)略低于低表达组(56.56%),但差异无统计学意义(P>0.05)。
4、乳腺癌
Ki67可准确判定乳腺癌是否出现转移,而EGFR更利于评估乳腺癌患者生存、复发情况,可将Ki67、EGFR联合检测用于乳腺癌预后的评估中,为临床诊治提供参考。
然而,国际乳腺癌研究组试验(IBCSGT)VIII和IX中,对于内分泌反应型淋巴结阴性患者,在内分泌治疗基础上添加CMF方案化疗,Ki67表达水平没有评估价值。
5、胃癌
Ki67在胃癌中没有预后价值,但可能是肿瘤内异质性的一个潜在指标。
6、淋巴瘤
对于淋巴瘤,Ki67值并不是越高预后越不好。比如伯基特淋巴瘤的ki67指数高达全切,几乎全切的肿瘤细胞都处在活跃的分裂期当中,然而伯基特淋巴瘤却有相对较高的治愈率。所以,ki67指数和预后的关系要依据不同的肿瘤分型来判断。
那么,在同一种分型中,是不是ki67越高预后越差?
也不能完全这么说。因为处于分裂期的细胞对化疗药物较敏感,所以有时候ki67较高,化疗的效果反而较好。所以,对于高ki67指数的淋巴瘤,要尽可能的用更多种类的化疗药物,用更高的剂量,用更多的化疗周期去攻击肿瘤细胞,力争不让耐药的情况出现。
为什么有时不同医院的ki67结果会不同?
首先,用的切片可能不同。虽然来自同一个蜡块,切下来的部位也许不一样。其次,用的抗体也许不一样。ki67染色有很多抗体,虽然较常用的是MIB-1,但是也有可能选用的是不同的抗体。三,计算的方法不一样。
一般是靠人工来数阳性细胞的,比如说选5个高倍视野,每个视野数200个细胞,或者选10个高倍视野,每个视野数100个细胞,然后取平均值。这是一项很繁重的工作,眼睛会数花的,所以,很多情况下病理医生凭经验估算,这样,主观的因素就起了较大的作用。当你看到病理报告上给出的ki67是一个含糊的数值,比如说ki67>50%,或者ki67(30%~50%),那么是没有严格的按照要求去数细胞。
见到过几份国外的病理报告,其中的ki67都是精确到小数点后一位的,显然,人家真的是按照规矩老老实实的去数了,然后取了平均值。当然,我确实想不出精确到小数点后一位有什么意义,所以,也没有必要去强求我们的病理医生去这么做。这只是体现出一种态度而已。
现在,也有图像分析软件可以来完成这项工作,不过,软件不能分辨哪些是肿瘤细胞,哪些是其它细胞,染色强度的判断标准也不统一,所以,做出来的恐怕还不如人工的准确。
Ki67值并非是预后指标
有研究显示肺癌中肿瘤的细胞形态、Ki-67阳性率和PCNA,以及临床分期和组织学分化为评估肺癌的发展和预后提供了有用信息。单变量和多变量生存分析显示,PBK/K表达与NSCLC的不良预后相关。PBK/K表达和Ki67或p53表达同时阳性的肿瘤患者的预后也明显不利。PBK/K表达与Ki67、p53表达呈正相关,可作为NSCLC的独自预后因素。
血清人附睾蛋白4(HE4)、Ki67水平能够作为诊断卵巢癌的指标,两者联合诊断价值更高。血清HE4<140pmol/L、Ki67<50pg/mL患者预后相对较好。
联合血清肿瘤标志物和Ki67的生存分析结果提示,结直肠癌均阴性时病人预后较好,单阳性时次之,均阳性时较差(均P<0.01)。
肿瘤预后与其他多种因素有关
预后的好坏和肿瘤的恶性程度、治疗方案和效果、癌细胞是否完全清除,医院的预后手段和患者的身体心理状态等多种因素有关。所以说ki67和预后之间并不能直接划等号。想要提高预后,需根据病人情况综合决定治疗方案,不同神经外科医师、放疗科决策者的经验和认识不同、病患的需求不同,都会造成治疗建议的差异,况且不论哪种治疗方案都是有潜在的益处和风险,病人个体也具有很大差异,对于很多尚有争议的领域,医学上也没有“统一、正确”的方案,很多时候医者也只能给出医学角度的建议。
参考文献:
1.Ki-67 is a valuable prognostic factor in gliomas: evidence from a systematic review and meta-analysis.Asian Pac J Cancer Prev. 2015;16(2):411-20.
2.Histopathology, cell proliferationindices and clinical outcome in 304 patients with mantle cell lymphoma (MCL): aclinicopathological study from the European MCL Network.
3.Association between Ki-67 Labeling index and Histopathological Grading of Glioma in Indonesian Population.Asian Pac J Cancer Prev. 2020 Apr 1;21(4):1063-1068.
4.Androgen Receptor and Ki67 Expression and Survival Outcomes inNon-small Cell Lung Cancer.Horm Cancer. 2018Aug;9(4):288-294.
5.Expression and significance of Ki-67 in lung cancer.Rom J Morphol Embryol.2018;59(1):227-233.
6.H3K27M和Ki-67在小儿脑胶质瘤中的表达及相关性.《中国肿瘤临床》2020年12期609-613,共5页




