引言:肿瘤免疫治疗是癌症领域的新热点,它的成功标志着人类抗癌斗争进入了三个阶段,从指导方针到评判标准全都变了。曾经轰动一时的“魏则西事件”将细胞免疫治疗推上风口浪尖。这是一个典型的“中国式求医”故事:父母变卖家产,四处奔波,为儿子治病,较终人财两空。当时的老百姓对于免疫治疗的印象也完全改变了,认为都是无效、骗钱的。而细胞免疫疗法究竟是编造的“神话”,还是真的是抗癌利器。很多身患绝症的病人,由于缺乏科学认知,总是希望抓住一根救命稻草,创造生命“奇迹”。近几年宣传火热的“CAR-T”技术同属细胞免疫疗法,也是“美丽骗局”吗?那真相究竟如何呢?高达300万一针,天价抗癌药Car-t细胞治疗是怎样的存在?
近来,国内外100-300万一针的CAR-T细胞疗法受到了多方面的关注,国内也有创新性的研发上市临床。一位患有复发性弥漫性B大细胞瘤的患者陈阿姨是这个神奇抗癌药的国内首位受益者——2021年6月,医院治疗团队为陈阿姨采集细胞后,8月将CAR-T细胞回输回体内。8月底详细检查后癌细胞竟然不见了,陈阿姨康复出院回家。这样神奇的作用是身体的“障碍法”还是“真治愈”,这种细胞疗法的效果当然还有待后续更长时间的观察和研究。但这样抗癌领域的突破,让给深受疾病困恼的患者带来了希望,大家都在感叹:科技的力量!
与此同时,该CAR-T细胞疗法的“天价账单”曝光,其治疗之昂贵令人咋舌:阿基仑赛注射液价格120万元/袋(约68ml),其他配套治疗费用,总价格接近200万。网友感叹“穷人治病,富人买命”的同时,一部分网友也表现出较大的期待:“虽然很贵,但这个是个突破啊,随着技术的发展说不定会越来越便宜,很多必死无疑的癌症患者都能得到治愈!”当然作为医者,还是期许越来越多的病患得到救治……

阿基仑赛注射液价格
在阿基仑赛注射液问世两个多月后,又一百万抗癌药横空出世。9月3日国家药监局官网显示,CAR-T疗法产品“瑞基奥仑赛注射液”获批上市,它是中国二款、6款获批上市的CAR-T 产品。
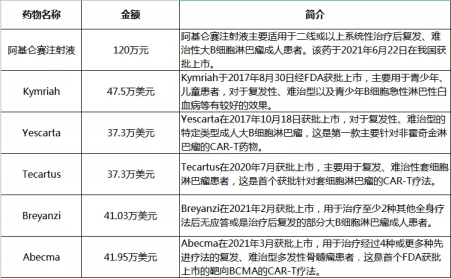
国内外仅单纯CAR-T药物费用就120-300万元之间
CAR-T疗法药物到底是何方神药?具体如何治疗?国内外如何发展?为何这么贵?疗效到底怎样?脑瘤治疗应用如何?要弄清楚这些问题,首先需要从CAR-T疗法说起:
过继细胞免疫免疫疗法包括非特异性免疫疗法 LAK、CIK、DC-CIK、NK 以及特异性的肿瘤浸润淋巴细胞(TIL)、CAR-T 及 TCR-T。CAR-T 疗法由于在血液肿瘤领域出色的疗效进入公众视野,同时引领着抗癌治疗进入新的时代。免疫治疗让我们一开始在与癌症的战争中看到胜利的曙光。
嵌合抗原受体修饰的 T 细胞免疫疗法(Chimeric Antigen Receptor T-Cell Immunotherapy,CAR-T),是指将编码来源于抗体的用于识别肿瘤细胞抗原的免疫球蛋白的单链可变区抗体(scfv)的重链可变区(VH)和轻链可变区(VL)的重组蛋白基因和 T 细胞杀伤激活信号 CD3ζ的 DNA 链,通过基因重组技术连接在基因工程表达载体上,并将其表达于杀伤性 T 细胞膜上形成嵌合抗原受体,从而使得 T 细胞不依赖 MHC-I而识别肿瘤细胞,再经纯化、体外扩增及活化,将 CAR-T 细胞回输至患者体内,使其特异性行使杀灭肿瘤细胞的功能。CAR 载体主要由 3 部分构成:抗原结合域、跨膜区及胞内信号转导区。
CAR-T具体如何治疗呢?
一个典型的CAR-T技术治疗流程,主要是5个步骤:
STEP 1 分离:从癌症病人身上分离出免疫T细胞

STEP 2 修饰:用基因工程技术给T细胞加入一个能识别肿瘤细胞并且同事激活T细胞的嵌合抗体,也即制备CAR-T细胞关键步骤

STEP 3 扩增:体外培养,大量扩增CAR-T细胞。一般一个病人需要几十亿乃至上百一个CAR-T细胞(根据个人情况而定)。

STEP 4 回输:把扩增好的CAR-T细胞回输到病人体内。

STEP 5 监控:严密监护病人,是控制前几天身体的剧烈反应。

整个疗程持续3个星期左右,其中细胞“提取-修饰-扩增”需要约2个星期。

CAR-T疗法工作原理
对抗癌细胞,外科手术、化疗、放疗是三大主要手段,其中,外科手术等于切掉癌细胞所在的身体组织,化疗等于对身体下毒杀死癌细胞和正常细胞,放疗等于对身体照射烧死癌细胞和正常细胞,这三种都属于用外力杀死癌细胞,而不同于这三大手段的CAR-T疗法则属于激活增强人身体内部的免疫系统,靠身体自身杀死癌细胞,从内解决问题。这让CAR-T疗法对身体的伤害足够的小,治疗效果也会相对更好一些。 其次,在杀死癌细胞之后,被基因编译过的T细胞依然留在了患者体内持续存在,起到了近似于疫苗的效果,因此对癌症的复发也有的抵抗效果。因而,CAR-T疗法作为癌症新型治疗手段前景较大。
CAR-T疗法国内外是如何发展的?
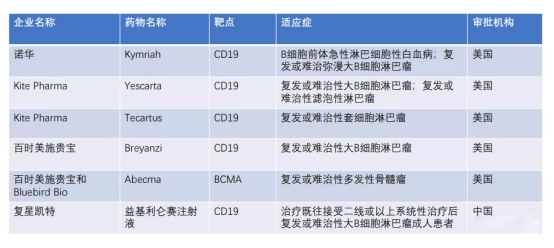
2012 年,在 Carl June 的一项针对儿童 B 细胞急性淋巴细胞白血病的 CAR-T 临床试验中,一个名叫 Emily的急性白血病患儿在二次复发无药可治的情况下,通过靶向 CD19 的 CAR-T 治疗,三周后肿瘤完全消失,至今 Emily 依然健康的活着,可以说 CAR-T 创造了人类历史上的医学奇迹,给无数癌症患者带来的新的希望。2017 年美国 FDA 批准了两项靶向 CD19 的 CAR-T 细胞疗法上市,即诺华的 Kmriah(tisagenlecleucel)和 Kite 的 Yescarta(axicabtagene ciloleucel),分别用于治疗儿童和青少年的急性淋巴细胞白血病(acutelymphoblastic leukemia,ALL)和特定类型的非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)。2021年6月22日,我国一款CAR-T细胞治疗产品由中国国家药品监督管理局获批上市,这也是我国首款获批上市的CAR-T细胞治疗产品。
CAR-T 疗法至今一发展到五代:一代 CAR 仅依赖于 CD3ζ介导 T 细胞激活,由于缺乏胞内共刺激信号,并不能提供长时间的 T 细胞扩增信号和持续的抗肿瘤效应,临床疗效有限;为了提高 T 细胞的增殖活性延长其存活时间,通过在胞内信号转导区增加一个或两个共刺激分子(CD28、4-1BB、ICOS 或 OX40等),由此产生了二代和三代 CAR,在现有的共刺激结构域中,CD28 和 4-1BB 是应用频率较高的共刺激分子,相比之下 4-1BB 作为共刺激信号的 CAR-T 细胞在体内扩增更温和持久,发生细胞因子风暴风险较低,复发率也更低;四代 CAR 则是引入了促炎症细胞因子(IL-12、IL-15、IL-18 等)和共刺激配体,主要目的是克服肿瘤免疫微环境的控制,例如,CAR-T 细胞中一种经常过度表达的细胞因子是 IL-12,这是一种增强 T 细胞分泌 IFNγ、颗粒酶 B 和穿孔素的合适分子,允许招募 NK 细胞消除 CAR 未能识别的肿瘤细胞;五代 CAR 则是在二代的基础上,添加了激活其它信号通路的共刺激结构域,比如 IL2-2Rβ胞内结合 SAAT3/5 的结构域等。目前大多数公司产品以二代 CAR-T 技术为基础,在此之上进行探索开发。

图示:历代CAR-T结构演变
百万起一针,CAR-T为何这么贵?
1.研发成本高:CAR-T药品从研发到上市,需要上百种研究的支撑。在这中间需要经过临床、药理、毒理、顺利性、GMP等检验,全部合格后才有获批上市的可能性,研究所花费的人力、物力等都昂贵,直接导致CAR-T产品的价格低不下来。比如,仅仅只做接桥试验的阿基仑赛注射液的研发费用就有6.75亿元之高。
2.生产成本高:和普通的药品不同,使用CAR-T疗法需要经过T细胞采集、APH洗涤、T细胞分选、冷冻、激活、转导、扩增、收获及配置、产品检测等繁琐的流程,生产的原料保存条件苛刻,而且并不是一次性完成大批量生产,导致生产成本高昂。
3.私人定制:CAR-T疗法是“私人订制”的治疗方式,它需要从患者体内分离免疫细胞,对免疫细胞进行“加工”后输入患者体内来和癌细胞抗衡,这种疗法只能“一对一”,不具备通用性。
4.所获适应症范围小:目前已经获批的CAR-T药品,适应症都只针对血液肿瘤,在肿瘤治疗上“小众”。目前开展的CAR-T临床,72%是血液肿瘤,实体瘤占比仅27%。未来如果不能在实体瘤的治疗上取得突破,CAR-T疗法的前景有限。除了已经上市的药物,目前还有近40款CAR-T疗法正在研发。未来会有更多的CAR-T药品进入市场,随着更多产品的出现,相信CAR-T药品的价格也会因为竞争的关系而下降。
已经上市的CAR-T 细胞疗法
(一)Kymriah:首款获批上市CAR-T疗法
Kymriah 由诺华研发,2017年8月获FDA批准上市,用于治疗B细胞前体急性淋巴性白血病(ALL),且病情难治或出现两次及以上复发的25岁以下患者;2018年,Kymriah获批复发或难治性大B细胞淋巴瘤的成人患者适应症。2019年10月30日,Kymriah 在中国获批临床,适应症为复发性或难治性侵袭性 B-细胞非霍奇金淋巴瘤,目前处于临床Ⅲ期。定价方面,Kymriah白血病适应症费用为47.5万美元,淋巴瘤适应症费用为37.3万美元。
1. B细胞前体急性淋巴性白血病(ALL)
25个研究中心,对75名晚期B细胞淋巴性白血病患者接受Kymriah治疗后,进行了3个月或更长时间的随访。
疗效数据:结果显示,81%的患者达到了客观缓解 (95%CI:71%-89%),80%的应答者在6个月时仍处于缓解期。60%的患者达到完全缓解(CR),21%的患者达到不完全血细胞计数恢复(CRi)的PR。在那些缓解的患者中,100%没有在骨髓中检测到微小残留病(MRD)。总生存期(OS)在6个月时为90%,在12个月时为76%。在这个难以治疗的患者群体中,中位OS为19.1个月(95%CI:15.2-NE)。
顺利性数据:47%的患者发生过3-4级的细胞因子风暴,两个死亡病例。13%的患者经历了3-4级神经相关的副作用,没有脑水肿产生。
2. 成人复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)
DLBCL是我国人群中较常见的淋巴瘤类型,占全部淋巴瘤的33.27%。临床多发于成年人和老年人,儿童少见,临床表现为迅速增大的性肿块,恶性程度较高,但对化疗反应较好。
疗效数据:在一项名为JULIET的研究中,共招募了93名DLBCL成人患者,数据显示,这93名患者的总体合适率(ORR)为52%(95% [CI],41%-62%),其中40%为完全缓解(CR),12%为部分缓解(PR),同时,在接受治疗后的3个月实现完全缓解的全部患者中,能够将CR状态维持到12个月的患者比例为80%,而中位的应答持续期数据尚未成熟。生存期方面,在全部接受细胞输注的患者(n =111)(95%CI,6.6-NE)中,12个月的OS率为49%,中位OS为11.7个月。从输注到数据截止的中位时间为14个月,较长输注时长为23个月。在数据截止时,Kymriah治疗后没有一个患者接受干细胞移植。
顺利性数据:在输注Kymriah之后8周内,发生3/4级细胞因子风暴(CRS)的患者比例为22%(3级14%,4级8%),15%的患者(包括发生2级CRS患者中的3%和发生3级CRS患者中的50%)接受了托珠单抗来对抗CRS,研究中未见报道发生脑水肿相关的死亡信息。
(二)Yescarta:国内获批上市的CAR-T细胞疗法
Yescarta 是一款由吉利德/Kite Pharma研发的靶向CD19的CAR-T细胞疗法,2017年获FDA批准用于既往接受二线或多线系统治疗的复发性或难治性弥漫性大B细胞淋巴瘤(DLBCL)成人患者的治疗;2021年3月5日,Yescarta获批用于治疗已接受过2种或更多种系统治疗方案的复发性或难治性滤泡性淋巴瘤(FL)成人患者。定价方面,Yescarta在美国市场的定价为37.3万美元。
2017年8月,吉利德科学以119亿美元收购Kite Pharma,并获得了Kite旗下Yescarta的权益。国内复星凯特拥有Yescarta大中华区权益,并于2021年6月22日获批上市。
1. 弥散性大B细胞淋巴瘤(DLBCL)
Yescarta DLBCL适应症的获批基于关键性临床研究ZUMA-1的数据。
疗效数据:共101例患者接受了Yescarta单次输注,其中72%的患者表现出缓解(总缓解率),51%的患者未检测到癌症残留(完全缓解率:95%CI:41-62)。在ASH2020上,吉利德披露在ZUMA-1试验中,患者的总生存期(OS)超过两年,而DLBCL患者接受化疗的生存期仅为6个月。
顺利性数据:该研究中有13%的患者经历了3级或更高级别的细胞因子释放综合征(CRS),31%的患者经历了神经系统毒性。常见的(≥10%)3级或更高级别反应包括:发热性中性粒细胞减少、发烧、CRS、脑病、病原菌不明感染、低血压、低氧血症、肺部感染。严重不良反应发生于52%的患者,包括:CRS、神经毒性、延长的血细胞减少(包括中性粒细胞减少、血细胞减少、贫血)和严重感染。该研究中发生了CRS和神经毒性致死病例。
2. 滤泡性淋巴瘤(FL)
滤泡性淋巴瘤(FL)是一种惰性非霍奇金淋巴瘤(iNHL),是二大常见的淋巴瘤类型,约占全国际诊断的全部淋巴瘤的22%。FL生长缓慢、但随着时间的推移侵袭性较强。目前,对于已接受过2种或2种以上系统治疗方案的复发性或难治性惰性FL患者,治疗选择有限。
疗效数据:FL适应症的获批基于ZUMA-5临床研究的结果,试验共纳入146例复发或难治性惰性非霍奇金淋巴瘤(iNHL)患者。试验结果显示,91%的FL患者对单次输注Yescarta表现出治疗反应,ORR达91%;其中,60%的患者病情获得完全缓解(CR)。
顺利性数据:在146例可评价顺利性的患者中,有8%和21%的患者观察到3级或更高疾病的细胞因子释放综合征(CRS)和神经系统毒性。CRS和神经系统毒性的中位发病时间分别为4天(1-20天)和6天(1-79天)。较常见的(≥10%)3级或以上级别的不良反应包括发热性中性粒细胞减少、脑病和不明病原体感染。
(三)Tecartus:首款治疗MCL的CAR-T细胞疗法
Tecartus 是一款由吉利德/KitePharma研发靶向CD19的CAR-T细胞疗法,T细胞内使用了4-1BB共刺激域。2020年7月,FDA批准Tecartus用于治疗复发或难治性套细胞淋巴瘤(MCL)成人患者。定价方面,Tecartus的MCL适应症定价为37.3万美元。
1. 复发性/难治性套细胞淋巴瘤(R/R MCL)
套细胞淋巴瘤(MCL)是非霍奇金淋巴瘤(NHL)的一个少见亚型,由淋巴结套区的细胞癌变引起,常见于60岁以上的男性。MCL在复发后具有高度侵袭性。在中国,MCL新发患者数约占NHL的3.5%,每年新发患者数约3100例。
Tecartus的批准基于Ⅱ期ZUMA-2试验数据,试验入组74例R/R MCL患者。这些患者的疾病对5种先前的治疗方案(包括基于蒽环类药物或苯达莫司汀的化疗方案,抗CD20单克隆抗体药物,BTK控制剂ibrutinib或acalabrutinib)无效或复发。
疗效数据:Tecartus单次输注治疗的ORR为87%(n=60例可评估疗效分析)、CR为62%。
顺利性数据:18%的患者(n=82例顺利性评估)经历了≥3级细胞因子释放综合征(CRS),37%的患者经历了神经系统事件。较常见(≥10%)≥3级不良反应为贫血、中性粒细胞减少症、血小板减少症、低血压、低磷血症、脑病、白细胞减少症、缺氧、发热、低钠血症、高血压、不明感染病原体、肺炎、低钙血症和淋巴细胞减少症。
(四)Breyanzi:顺利性较高的上市CD19CAR-T产品
Breyanzi 是BMS旗下一款靶向CD19的CAR-T产品,2021年2月,美国FDA批准Breyanzi 用于弥散性大B细胞淋巴瘤成年患者的治疗(DLBCL)。Breyanzi定价为41.03万美元。
1. 弥散性大B细胞淋巴瘤(DLBCL)
Breyanzi的获批上市基于TRANSCEND NHL001临床试验。
疗效数据:试验结果表明,在可评估疗效的192例患者中,73%(95%CI:67%-80%)实现缓解,其中完全缓解率为54%(CR;95%CI:47%-61%),部分缓解率为19%(PR;95%CI:14%-26%)。全部产生应答的患者中,中位缓解持续时间为16.7个月(95%CI:5.3-NR);实现CR的患者中,中位缓解持续时间未达到(95%CI:16.7-NR);对于较佳应答为PR的患者,中位缓解持续时间为1.4个月(95%CI:1.1-2.2)。接受Breyanzi治疗且较佳总体应答为CR的104位患者中,65%缓解持续至少六个月,62%缓解持续至少9个月。
顺利性数据:对268例接受Breyanzi治疗的患者进行了顺利性评估。使用Lee氏分级,46%(122/268)的患者发生CRS,其中3级及以上CRS出现在4%(11/268)的患者中。死亡时,一名患者发生致命的CRS,两名患者在经历CRS。CRS较常见的表现包括发烧(93%)、低血压(49%)、心动过速(39%)、畏寒(28%)和缺氧(21%)。CRS中位持续时间为5天,中位发作时间为5天。接受Breyanzi治疗的患者中,35%(95/268)发生了神经毒性(NT),其中3级及以上NT出现在12%(31/268)的患者中。死亡时,一名患者发生致命的NT,七名患者在经历NT。较常见的NT包括脑病(24%)、震颤(14%)、失语症(9%)、谵妄(7%)、头痛(7%)、共济失调(6%)和头晕(6%)。95名患者中有81名(85%)的NT被解决,中位持续时间为12天,中位发作时间为8天。全部患者NT中位持续时间为15天,包括死亡或数据截止时仍在经历的患者。
(五)Abecma:首款获批上市BCMA CAR-T疗法
Abecma 是BMS和Bluebird公司联合开发的、获批上市的靶向B细胞成熟抗原(BCMA)的CAR-T疗法。2021年3月,Abecma获FDA批准用于既往接受过四种或更多种疗法(包括3类药物:免疫调节剂、蛋白酶体控制剂、抗CD38抗体)的复发性/难治性多发性骨髓瘤(r/r MM)的成人患者。Abecma定价为41.95万美元。
1. 多发性骨髓瘤(MM)
Abecma的获批上市基于名为KarMMa的关键性Ⅱ期临床试验。该试验对127例复发/难治性多发性骨髓瘤患者进行了治疗,这些患者至少接受了三种前期疗法。
疗效数据:试验结果表明,可评估疗效人群的总缓解率(ORR)为72%,其中CR达28%,数据亮眼。从疗效数据的角度,Abecma作为一款靶向BCMA的CAR-T疗法,疗效优于CD3×BCMA的双抗疗法。
顺利性数据:全部接受Abecma治疗的患者中,顺利性状况良好,主要发生低水平的细胞因子释放综合征(CRS)和神经毒性(NT),并且具有可评估的早期发作和缓解。使用Lee评分系统,CRS的发生率为85%(108/127),≥3级CRS的发生率为9%(12/127),其中一名患者发生5级CRS。NT的发生率为28%(36/127),≥3级NT的发生率为4%(5/127),一名患者死亡的时候正在经历NT。
CAR-T的疗效到底怎样?
陈阿姨经过CAR-T治疗后痊愈让很多患者重新振奋,但需要注意的是,并不是全部患者都能达到这个效果。根据国际上的一项研究数据,CAR-T免疫治疗复发/难治性急性B淋巴细胞白血病患者的完全缓解率超过90%,治疗慢性淋巴细胞白血病的完全缓解率为23%-50%,治疗B细胞型非霍奇金淋巴瘤患者的完全缓解率从47%到90%以上不等。
虽然CAR-T细胞治疗是一种个性化针对个体的准确治疗,效果好,但合适率也并不是100%,而且CAR-T细胞回输后也可能会出现失活等情况。另外,能接受CAR-T治疗的患者依然会有30%-60%较终复发,亦有一部分患者会出现耐药。所以这项效果好的治疗方法并不是注射一剂CAR-T细胞就高枕无忧,整个治疗周期的每一个环节都需要专家谨慎评估。
当然一些人对于“天价药物骗局”的评价也大可不必,此次是由中国国家药品监督管理局已经批准的,由此可见,CAR-T细胞疗法是靠谱的,科学的,经过验证的。
CAR-T细胞疗法脑瘤治疗应用如何?
CAR-T疗法确实是一种好的癌症药物,但是仅仅只对部分血液肿瘤患者(例如白血病、淋巴瘤等)具有不错的疗效,但就目前的研究还谈不上治愈,还需要更长期的临床观察。在治疗血液瘤如此之好的前景下,CAR-T细胞疗法自然而然地向实体肿瘤发起了进攻。目前临床上也开始尝试多种疗法和CAR-T细胞疗法联用,从而打破肿瘤微环境的束缚——比如与放化疗、免疫检查点控制剂等的联用,可以合适地降低肿瘤微环境的控制。
CAR-T细胞疗法可以治疗脑瘤吗?CAR-T细胞疗法治疗脑瘤各个国家仍处于试验阶段,有较个别脑瘤患者从中获益,目前仍未应用临床治疗。脑瘤患者不应盲目追求天价靶向药,建议首先按照国内外标准的治疗指南或规范进项治疗,对于原发性中枢神经系统淋巴瘤或全身性弥漫性大B淋巴细胞瘤,目前的一线治疗也能有很好的治疗缓解甚至是病灶完全缓解效果,对于其他的很多脑瘤首先看看手术能否完整切除,这是大多数脑肿瘤一线治疗手段,手术全切是大多数脑瘤获得良好预后的重要一环,对于恶性脑瘤而言,较大水平手术切除也将确定后期辅助的放化疗效果较大化。
魏则西,一个年轻生命的逝去令无数人惋惜、愤恨……医学也本无“神话”,但是希望在各位医学同仁的共同努力下,我们能够创造“神话”。我们可能也无法击溃生活中非生命的,但只要对生命心存渴望,只要在步履匆匆的旅途中能时时停顿下来,不忘初心,重拾前行的信心,拯救生命……
较后附上《瓦尔登湖》节选,作者梭罗。愿我们都能把非生命的都击溃!
我步入丛林
I went to the woods.
因为我希望生活得有意义
Because I wanted to live deliberately.
我希望获得深刻
I wanted to live deep.
汲取生命中的全部精华
and suck out all the marrow of life.
把非生命的都击溃
To put to rout all that was not life.
以免当我生命终结时
And not, when I came to die.
发现自己从没有活过
discover that I had not lived.
参考资料:
- 1.Current challenges and emerging opportunities of CAR-T cell therapies.Teresa Abreu, Nuno A. Fonseca, Nélio Gonçalves, João Nuno Moreira.Journal Pre-proof.2019
- 2.https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm572131.htm
- 3.https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm570038.htm
- 4.https://www.fda.gov/newsevents/newsroom/pressannouncements/ucm569421.htm
- 5.https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm574058.htm
- 6.【优医说】因魏则西而“蒙冤”的免疫治疗—CAR-T




