全部分析均使用GraphPad Prism执行。使用事后Scheffé检验进行单向方差分析,以分析每个WHO等级的PRR IHC评分,Ki-67标记指数和肿瘤的增殖活性(WST-1分析)。应用双向方差分析确定PRR siRNA的转染效果和潜伏期对人GBM细胞系中细胞数的影响。使用Spearman秩相关系数检验分析PRR IHC评分与Ki-67标记指数之间的相关性。使用Kaplan-Meier方法绘制按PRR IHC评分分类的两组神经胶质瘤患者的生存曲线。
结果表明:每个WHO等级的人神经胶质瘤中的PRR表达。免疫组织化学显示,GBM细胞具有较强的胞质PRR表达,而正常组织中PRR表达明显较弱(图1A)。另外,来自3种人GBM细胞系的裂解物中的PRR表达高于原代星形胶质细胞的裂解物中的PRR表达(图1B)。这些结果表明GBM病变高水平的PRR表达。
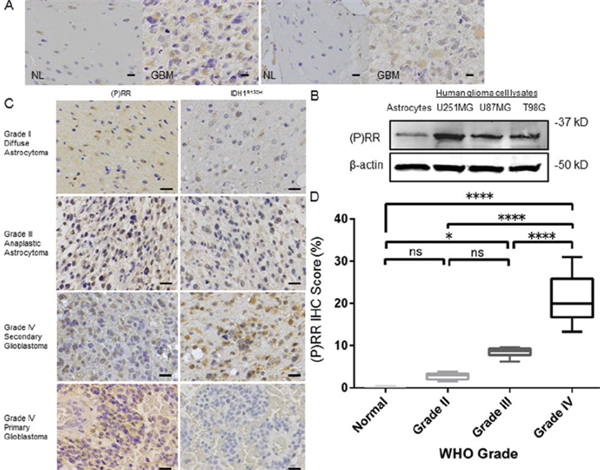
图1:每个WHO等级的神经胶质瘤中的PRR表达。通过IHC分析评估2名GBM患者的代表性肿瘤样品中PRR的表达。在边缘的正常脑组织(NL)和GBM组织之间比较了PRR的表达,揭示了在肿瘤细胞的细胞质中强大的PRR免疫反应性。比例尺= 20μm。B:人星形胶质细胞和3GBM细胞系的细胞裂解物中全长PRR蛋白表达的蛋白质印迹分析。β-肌动蛋白用作负载对照。在3个实验中获得了相似的结果。C:神经胶质瘤组织中PRR的免疫组织化学特征。两个GBM组织样品均显示出比弥散或间变性星形细胞瘤更强的细胞质PRR免疫反应性。IDH1 R132H除原发性GBM外,全部神经胶质瘤均表达。比例尺= 20μm。D:每个WHO等级的正常脑组织和神经胶质瘤中的PRR IHC评分。随着恶性肿瘤的进展,评分增加。该盒包括结果的四分位数间距。穿过每个框中间的线代表中位数。
在每个WHO等级的神经胶质瘤中也证实了PRR表达(图1C)。总结了31名神经胶质瘤患者的人口统计学和临床病理特征。IHC PRR的表达水平用软件程序(cellSens,Olympus Corp.)计算出的分数(PRR IHC分数)表示,正常组织的平均分数为0.24%(范围为0.11%–0.46%),为2.8 II级神经胶质瘤的百分比(范围为1.59%–3.78%),III级神经胶质瘤为8.4%(范围为6.25%–9.54%)和IV级神经胶质瘤为21.2%(范围为13.33%–30.99%)。在主要和次要GBM中均检测到PRR表达,但IDH1 R132H仅主要GBM阴性(图1C))。GBM中的PRR表达明显高于低级神经胶质瘤和正常组织(图1D)。总体而言,这些发现表明,无论是否存在IDH1 R132H,PRR表达随WHO等级的升高而增加。
本研究表明,PRR通过异常激活Wnt /β-catenin信号通路在神经胶质瘤的发生中起重要作用。PRR可能是全部级别神经胶质瘤的潜在预后指标和治疗靶标。
参考文献:DOI: https://doi.org/10.3171/2016.9.JNS16431
请搜索“神经胶质瘤”获取更多有关神经胶质瘤的信息。




