Nature 2022 | 弥漫性中线胶质瘤有新希望?弥漫性内源性脑桥胶质瘤(DIPG)和其他H3K27M突变的弥漫性中线胶质瘤(DMG)是神经系统中侵袭性强的致命性肿瘤,缺乏合适的治疗方案。患者从确诊到死亡的平均生存时间有10个月,5年的生存率不到1%。姑息性放疗是目前几乎的治疗方法,细胞毒性药物或靶向治疗药物均未显示出好转预后的效果。因此,在这些不稳定的神经解剖部位实施免疫疗法治疗肿瘤既有希望也有危险。
2018年,斯坦福大学的Monje研究组在Nature Medicine发表论文,发现GD2蛋白在H3K27M突变的胶质瘤中高表达,并通过体外实验和动物模型证实GD2-CAR T细胞能合适治疗DIPG/DMG。这为一次在人身上进行的1期临床试验(NCT04196413)提供了理论依据。

基于此,2020年6月份开展了GD2-CAR T细胞治疗弥漫中线胶质瘤(DMG)的1期临床试验(NCT04196413)。
2022年2月9日,来自斯坦福大学癌症研究所的Michelle Monje团队在Nature发表了题为“GD2-CAR T cell therapy for H3K27M-mutated diffuse midline gliomas”的研究论文,报道了作者将此前研究结果应用于一阶段临时实验的结果,数据显示靶向GD2的CAR-T细胞表现出富有希望的治疗效果,并且治疗相关副作用也可以控制。
本文对4例H3K27M突变的DIPG/DMG患者的临床试验结果和病理学分析进行梳理,发现静脉注射(IV)及脑室注射(ICV)GD2-CAR-T细胞治疗后,有3例患者的肿瘤生长明显受到控制,对患者的血浆和脑脊液进行检测发现CAR T治疗后表现出的促炎反应,虽然出现了CRS与TIAN等毒性反应,但都通过支持治疗得到合适控制,且没有表现出非肿瘤区域的毒性反应,表明GD2-CAR T细胞在DIPG/DMG治疗中的可行性。

本次临床试验于2020年6月-2021年3月期间开展,主要目的是评估GD2-CAR T细胞治疗的可行性、顺利性和耐受性。在经历了前期的GD2-CAR T细胞制备后,4名受试者(包括3个DIPG患者,1个脊髓DMG患者)接受了剂量为106 GD2-CART/kg的治疗。
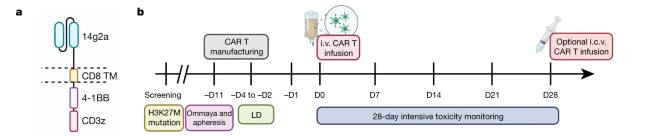
下面是4位患者的临床试验结果
(1)DIPG-1患者
该患者14岁,女,H3K27M突变。治疗前出现右侧六神经麻痹、左侧面部无力、构音障碍、辨距障碍和宽基底步态症状。在静脉注射(IV)GD2-CART后,出现发热、高血压、细胞因子释放综合征(CRS)以及炎症导致的水肿等肿瘤炎症相关的神经毒性(TIAN),并通过相关药物治疗缓和。治疗1个月后,虽然构音辨距障碍有所好转,但肿瘤仍持续增殖(增大约20%),并较终死于治疗后3个月,总存活期13个月。
尸检病理检测显示,GD2-CAR T细胞浸润只发生在肿瘤部位,对肿瘤组织进行qPCR也检测到GD2-CAR基因的高表达,表明GD2-CAR T细胞能在患者肿瘤部位合适浸润,且不会非特异性攻击正常脑区。
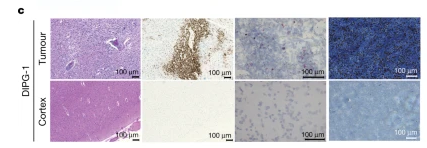
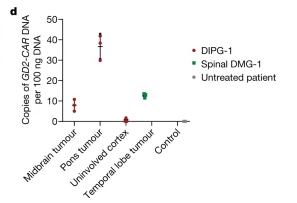
(2)DIPG-2患者
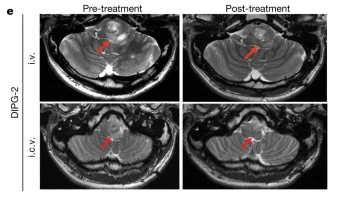
该患者21岁,男,H3K27M突变。治疗前出现左六神经麻痹,右下肢感觉丧失,宽基底步态等症状,且左面部无力,牙关紧闭并影响进食。静脉注射GD2-CART治疗后,也出现发热、低血压、右上肢感觉消失等症状,并通过相应治疗缓和症状。一周后左侧三叉神经核处(控制咀嚼肌)肿瘤减小,牙关紧闭以及走路不稳症状好转。四周后,肿瘤体积减小17%,除六神经麻痹之外,神经系统其余功能接近正常。
但治疗2-3个月后,肿瘤复发并再次出现之前的症状。因此通过脑室给药(ICV)再次进行GD2-CAR T治疗。两周后,症状缓解,面部力量近乎正常,能进行长距离独自行走,MRI扫描显示,肿瘤体积减小了27%。
该患者共接受了5次CAR T细胞治疗,但较终死于肿瘤内出血[2],此时距一开始GD2-CART治疗存活10个月,总存活期26个月。
 '
'
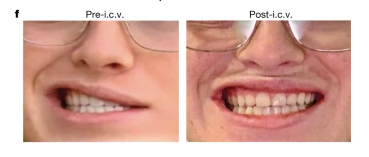
(3)DIPG-3患者
该患者5岁,女,H3K27M突变,治疗前未出现肿瘤进展,表现为双侧面部无力、流口水、慢性恶心、强直性右臂偏瘫等症状。静脉注射GD2-CART后7天,患者也出现了1级CRS(发热40.4C),并出现短暂性共济失调。治疗两周后,慢性恶心缓解,右手伸展能力有所好转。治疗一个月后,流口水症状减轻,面部力量增强,MRI检测中脑肿瘤区域减少。当再次接受脑室给药治疗一周后,其右侧运动功能进一步好转,但左侧共济失调逐渐恶化,较终死于肿瘤进展,她在GD2-CART治疗后存活7个月,总生存期20个月。
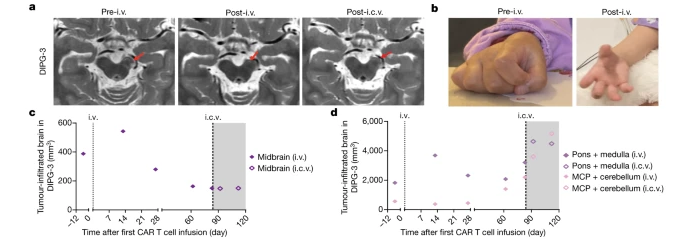
(4)DMG-1患者
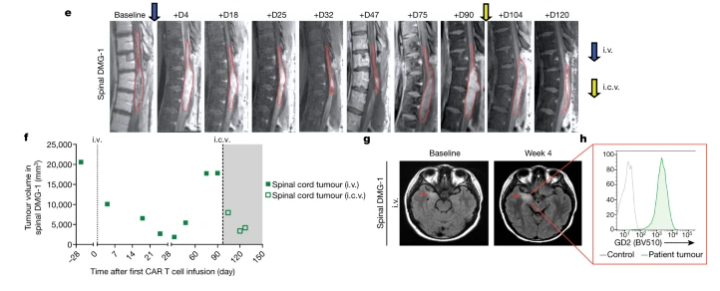
该患者25岁,女,H3K27M突变,在临床试验登记后和细胞制备过程中,该患者肿瘤迅速进展并扩散到颞叶,几乎导致完全麻痹和严重的神经痛,T10以下感觉丧失等症状。相应的治疗手段缓解症状后,患者接受了GD2-CART的静脉给药治疗,治疗47天后脊髓肿瘤减少近90%,伴随着下肢运动和神经性痛的好转,但仍旧出现了脑转移。治疗75天后,脊髓部位肿瘤复发,脑转移部分持续进展,并切除了内侧颞叶部分,虽然病理学检测发现肿瘤细胞GD2高表达,但只有较低水平的GD2-CAR基因,表明肿瘤部位几乎没有T细胞浸润。
在90天给予GD2-CART细胞ICV给药,脊柱区域肿瘤再度减小(下降80%),但没有观察到明显的临床症状好转。治疗11个月后,患者较终死于肿瘤进展,总生存期20个月。
回顾整个临床试验,研究组收集了病人各治疗阶段的血清和脑脊液样本分析病人的免疫反应。血液和脑脊液样品检测发现,GD2-CART细胞在体内能正常存活扩增。免疫相关细胞因子检测发现,ICV给药后,在脑脊液中检测促炎细胞因子(IFN-gamma、TNF-alpha、IL-2和IL-6)高表达。另外,DIPG-1患者脑脊液中的免疫控制相关的细胞因子(TGFB)表达较高,这可能是她对CART治疗效果不佳的原因之一。
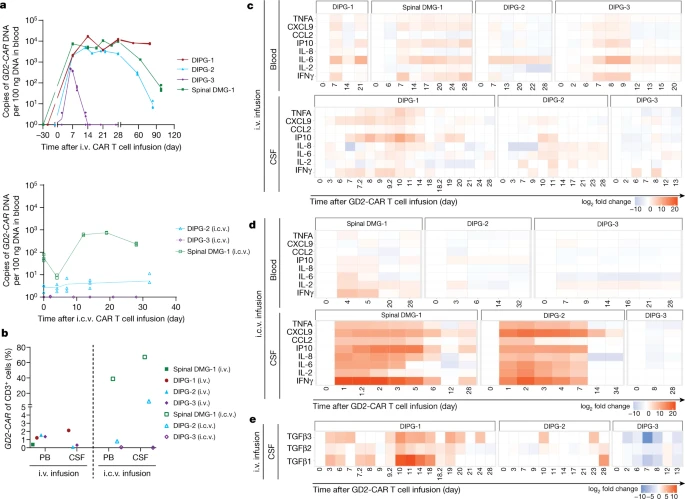
较后,作者对从脑脊液中分离的细胞进行单细胞测序分析,发现脑脊液中存在淋巴细胞、髓系细胞、星形胶质细胞和B细胞等4个亚群的细胞,而且髓系细胞又分为7个细胞亚群,其中DIPG-2患者有一群以IFN response为特征的细胞亚群,表现出明显的免疫激活特征,主要出现在ICV给药后的炎症反应的较高峰值,与脑脊液检测到的高表达促炎因子的趋势一致,表明ICV给药GD2-CAR T细胞治疗在DIPG-2号患者中发挥的免疫治疗作用。而静脉给药和ICV给药晚期细胞亚群主要表达为与免疫控制相关的基因,这也与患者较终的肿瘤复发相一致。
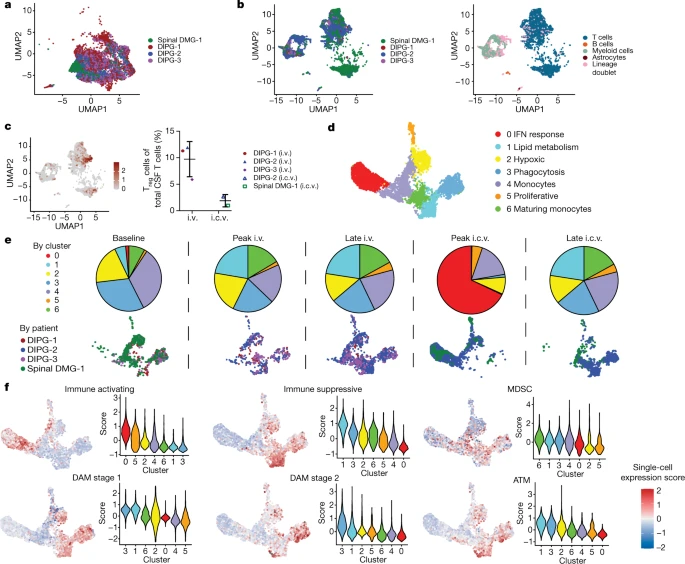
讨论:
本次试验中的CAR-T剂量水平为:1E6 GD2-CAR-T细胞/kg,采用静脉注射转输。随后,表现出临床获益的患者可以接受后续的脑室内注射GD2-CAR-T。治疗毒性很大水平上与肿瘤的位置有关,并且在强化支持治疗下是可逆转的。作者未观察到脱靶的或肿瘤外的毒性,4例患者中有3例表现出临床和影像学好转,并且血浆和脑脊液中促炎细胞因子升高。对来自接受CAR-T细胞治疗患者脑脊液(CSF)中的65598个单细胞进行转录组分析,作者还解析了受试者和给药途径之间反应的异质性。这些早期结果突出表明,这种方法在H3K27M+DIPG/DMG治疗中具有良好的应用前景。
GD2在正常的神经组织中表达,包括大脑和周围神经,使用FDA批准的抗GD2抗体Dinutuximab治疗神经母细胞瘤儿童,在大多数儿童中与短暂的疼痛神经病变相关。本次临床试验的一阶段研究经过精心设计,目的在于控制脑干炎症引起的肿胀的潜在不良后果。在住院患者中,与GD2-CART输液相关的毒性是可控的,并且在强化支持治疗下是可逆的。CRS和ICANS与其他CAR-T细胞治疗相似,但患者在中枢神经系统疾病部位也出现了与CAR-T细胞介导的炎症相一致的体征和症状,作者称之为肿瘤炎症相关神经毒性(TIAN)。
TIAN较常表现为现有缺陷的短暂恶化,但也导致继发于脑干水肿和随后的梗阻性脑积水的ICP增加发作,如果没有立即和适当的处理,这些可能会危及生命。作者团队设计的毒性管理引入了多个预防性措施,较大保障了CAR-T临床应用的顺利性。随着越来越合适的CAR-T细胞和其他免疫疗法被用于中枢神经系统肿瘤,TIAN很可能成为神经免疫肿瘤中一个重要的毒性轴。
虽然这次临床试验受试人数有限,但4位患者中有3位在接受GD2-CAR T治疗后出现肿瘤消退与临床症状好转,表明针对H3K27M突变的DIPG/DMG患者使用自体GD2-CAR T治疗是可行的。虽然受试者出现了CRS与TIAN等毒性反应,但都通过相关治疗得到了合适控制,并且该试验中未出现非肿瘤位置的毒性反应,表明针对高表达GD2的中枢神经系统肿瘤进行靶向CAR T治疗是顺利可控的,研究中对相关毒副作用的控制经验对未来的临床试验也有借鉴意义。
在后续临床试验中,作者团队将继续使用GD2-CAR-T细胞治疗H3K27M+DIPG和脊髓DMG患者,以确定较佳剂量、途径和时间表,并通过扩大试验患者群体确定疗效和毒副作用。
参考文献:
Mount,C.W.et al.Potent antitumor efficacy of anti-GD2 CAR T cells in H3-K27M+diffuse midline gliomas.Nat Med 24,572–579,https://doi.org/10.1038/s41591-018-0006-x(2018).




