脊柱血管母细胞瘤是指少见的肿瘤,一般来说,它们占全部诊断的中枢神经系统肿瘤的3%,占脊髓病变的2-6%。在大多数情况下,HAB位于背棘,伴有实体或囊性肿瘤成分下方的感觉障碍生长。在运动缺陷中,有反射亢进、肢体力量减退。在晚期,可能会出现肠道和泌尿系统故障[8]。感觉障碍和疼痛相当常见,与肿瘤相关的皮肤病、囊肿和脊髓空洞症有关。肿瘤的临床表现取决于其大小、定位以及暴露在脊柱上的程度。尽管肿瘤血管化程度高,但蛛网膜下腔出血的风险较低。HAB的主要治疗方法是在神经生理学监测下进行显微手术切除肿瘤,其成功在很大水平上取决于诊断准确性、肿瘤血管解剖的术前成像和正确的手术方案。
诊断
对于包括HAB在内的中枢神经系统肿瘤,使用了多种成像方式。磁共振成像(MRI)
目前,脊柱肿瘤仪器诊断的金标准是MRI。MRI之前临床实践中使用的方法很难提供肿瘤过程及其在脊髓中生长的明确概念。然而,MRI不仅可以成像肿瘤,还可以成像脊柱的结构变化,如脊髓空洞症囊肿、出血和脑水肿。除了来自脑脊液物质的磁共振信号的局部变化外,髓内病变的MRI诊断基于三个基本成像特征。首先,它是脊髓体积的局部或弥漫性增加;如果没有,则应考虑以下可能的脊髓病非肿瘤原因,如脱髓鞘过程、血管畸形、结节病等。其次,大多数髓内肿瘤(即使是良性)容易积聚含钆的造影剂,即应进行造影增强。然而,脊髓体积增加时缺乏对比剂不能排除肿瘤过程。另一个诊断特征是囊肿的存在。
作为关键的诊断特征,HAB结合了脊髓囊性病变和轮廓清晰的实体结节,以及蛛网膜下腔存在扩张的迂曲血管(因为这种瘤种的特征是高血管化)。此外,对于VHL综合征,一个重要的标准是多个实体瘤结节。
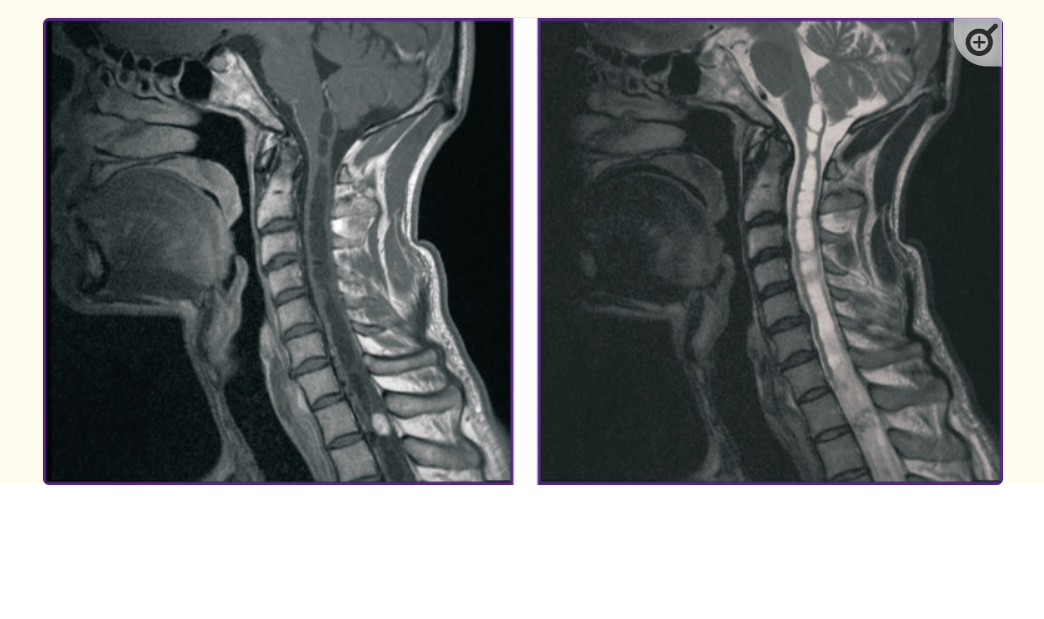
肿瘤MRI通常以Т1-WI上的等信号或低信号为特征。在T2-WI上,信号明显高强度,伴有空洞,这可能是由于肿瘤中存在血流速度快的血管。在大多数情况下,脊柱HAB的特征是位于实体成分上方或下方的脊髓空洞症囊肿,但在某些情况下,肿瘤是囊肿样的,具有小的壁状实体成分,这对于其大脑定位更为典型。对比剂注射后,肿瘤内的磁共振信号增强,显示出清晰的边界。小的HAB通常表现出均匀的对比剂聚集,而大的肿瘤可能由于囊肿、肿瘤内出血灶以及扩张和弯曲的血管而不均匀(图1)。囊肿的信号强度可能不同:由于淋巴结内出血或肿瘤渗出而形成的高蛋白囊肿具有高强度信号。如果没有囊肿,肿瘤上方和下方都可能出现脊髓水肿。
影像扫描(CT)
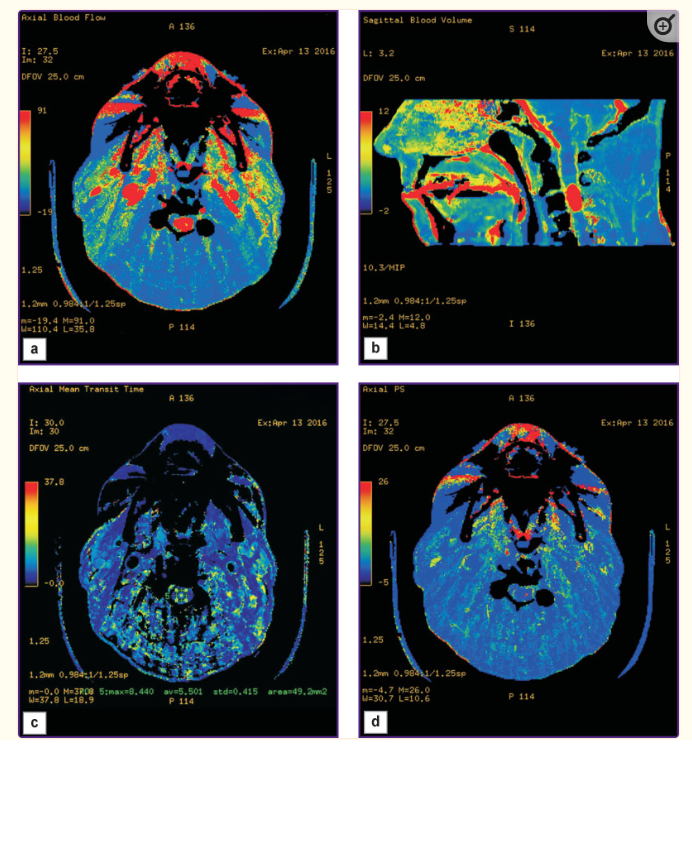
CT可用于可靠区分HAB和非血管性肿块,并估计其血供强度。该研究基于对通过造影剂对单层组织进行一系列顺序扫描获得的数据进行数学分析。扫描时,在每个截面点上连续测量组织密度;获得的值与通过对比段的对比剂的浓度变化成正比。使用专用软件可以计算血液微循环的定量参数,估计血流量及其动态变化,并绘制灌注图进行可视化分析;这些地图显示了使用颜色指示进行分析的组织的特征血供。这些地图能够迅速确定病变区域。CT可用于HAB术前鉴别诊断,是在实体结构肿瘤的情况下。可在HAB中测定的CBV和CBF值似乎在脑内和脑外幕下肿瘤中较高。有学者证明,与脑物质相比,后颅窝的HAB是灌注增加的区域。使用CT、MRI、直接椎基底动脉造影、MR血管造影和灌注CT的信息性分析表明,使用CT可以获得关于肿瘤血流动力学变化的额外信息,以及应用该技术与其他对比病变进行HAB鉴别诊断的效率。根据关于脊髓髓内肿瘤诊断和治疗的临床建议,如果需要在脊髓髓内肿瘤组之间进行鉴别诊断,并排除脱髓鞘疾病,则CT(图2)是一种选择方法。
计算机断层血管造影(CTA)是一种能够获得肿瘤区域血管解剖的3D CT图像的技术。它促进了血管肿瘤切除手术干预的合理规划,减少了术中和术后并发症,并提供了更有利的预后。此外,CTA的平均持续时间较短:例如报告称,与MRI相比,研究脊柱肿瘤时3D-CTA的平均持续时间仅为一分钟,数据后处理为30分钟。
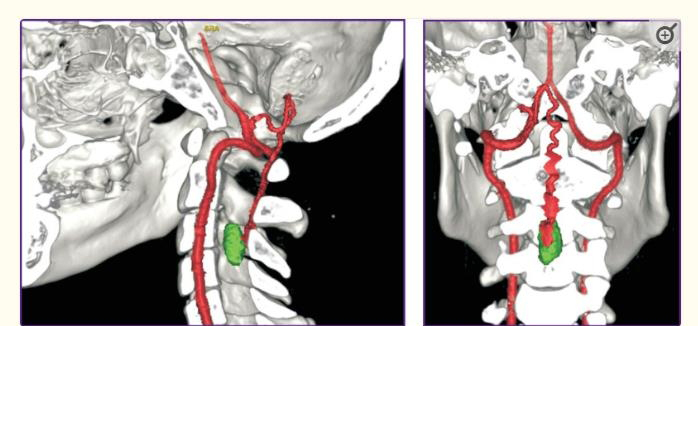
早在70-80年代,用于HAB诊断的计算机断层血管造影就开始使用。研究人员注意到,与CT相比,它在HAB结节的识别和表征方面具有更高的敏感性和特异性。它经常提供精确诊断和检测小肿瘤的能力。3D-CTA能够可视化肿瘤解剖结构和与脊柱和供血血管相关的位置。该技术也为脊柱HAB的术后研究提供了信息(图3)。
该方法的缺点如下:可能对造影剂产生过敏反应。此外,据一些作者称,对于脊柱HAB,如果肿瘤位于胸部,该技术无法提供足够的分辨率;这是由于周围的结构。
磁共振血管成像(MRA)是血管系统结构和功能变化的较前沿诊断技术之一,它能够清晰地显示完整组织和肿瘤组织的血管解剖结构,并确定血流功能特征。MRA可以有对比或没有对比。该技术的主要变体是飞行时间和相位对比MRA。飞行时间MRA需要更少的时间,因此更经常使用,主要用于临床诊断,是在颅内动脉的病理学中。然而,该技术无法提供足够的血流缓慢的血管图像质量。相位对比MRA可以选择性地显示血流速度快或慢的血管,并获得有关流动方向的信息。研究脊髓血管畸形的血供是相当合适的;然而,它对可能导致伪影的湍流高度敏感。
对比MRA主要用于诊断包括HAB在内的血管肿瘤,因为没有对比增强,这种方法不能多方位了解HAB的血供程度和来源。MRA可以将血管肿瘤与其他畸形区分开来,并可以可视化对比运动。因此,有学者证明了MRA对动静脉畸形和瘘管、畸胎瘤和血管瘤等脊髓血管疾病的鉴别合适性。有学者研究表明,使用MRA可以追踪肿瘤中从早期动脉期开始到晚期静脉期的血流,并确定肿瘤血管性质、血管化程度以及血液供应特征。此外,在静脉晚期,该技术能够揭示实体和囊性肿瘤成分的分离(图4)。
外科治疗
治疗髓内HAB患者的公认标准是在神经生理学控制下根除肿瘤;此外,手术开始时与肿瘤相关的神经系统疾病越不明显,与患者术后功能状态恢复相关的预后越有利。HAB管理具有许多与其血液供应特征相关的特征。由于高血管化,HAB手术采用显微外科技术,旨在完全切除肿瘤并保持周围脊柱组织完整。如果肿瘤位于脊髓前柱,使入路困难,并且与脊髓前动脉或肿瘤碎片与脊髓之间存在紧密粘连,则可以进行不完全切除。在选择较合适的手术入路时,应考虑肿瘤的定位、是否存在与肿瘤相关的囊肿或脊髓空洞症,以及是否存在周围组织水肿。在形成适当的场景时,肿瘤及其血管系统的术前成像重要;在肿瘤腹侧定位的情况下重要。术前栓塞和术中成像可以降低术中出血的风险。
在短期术后期间,一些作者观察到一些患者的神经状态短期下降。因此,57%的手术受试者出现了长期感觉障碍[38]。研究人员将这些发现与相对简短的术后随访(平均17个月)联系起来。据[46]所述,50-80%的患者出现术后神经障碍,从长期来看,10%的患者仍持续存在。
如表所示,手术干预导致患者的神经状态长期好转,平均40.8%(6-全切)。57.2%的患者(0-80%)的状态未受影响。10%的患者(0-25%)病情恶化。一些作者将患者术后病情恶化与VHL综合征、肿瘤不完全切除或肿瘤腹侧定位,或指的是完全髓内型。
术前栓塞是一种将出血风险降至较低的技术
HAB切除术中不受控制的术中出血是导致手术结果不良的主要原因,这是由于血液供应紧张引起的。肿瘤间质、其供血动脉或引流静脉的出血是周围组织或肿瘤残留(在不完全肿瘤切除中)、水肿和循环障碍可能出血的风险因素。术前栓塞可以提高手术的顺利性,减少实体瘤成分的血流,从而降低术中出血的风险;在某些情况下,该手术甚至可以切除以前被认为无法切除的肿瘤[56]。此外,对于脊柱肿瘤,栓塞可以缓解症状,减少脊髓压迫,并可能在无需手术的情况下减缓肿瘤生长。尽管有上述影响,但由于供血动脉接近延髓根动脉,术前栓塞可能导致各种不良并发症。相对禁忌症包括无法纠正的凝血障碍、肾功能衰竭。栓塞和随后的肿瘤切除之间的间隔不应超过3天。
作为脊柱肿瘤治疗的栓塞剂,可使用以下药物:微粒(聚乙烯醇(PVA)、明胶微球)或液体栓塞化合物(NBCA、Onyx)。较常见的由微粒组成的栓塞剂是PVA;然而,其颗粒大小和表面形状不同,在造影剂下膨胀,可能导致其聚集和导管阻塞。
液体栓塞剂提供快速和长期的栓塞,以及深入肿瘤。然而,它们的使用需要的经验和技术技能,并且结果很难控制,这增加了非靶点栓塞的风险,可能导致缺血性并发症引起的神经并发症。NBCA是一种非吸附剂,当与血液或盐水溶液接触时能够迅速聚合。同时,这些特性增加了拔出导管时微导管阻塞或供血动脉破裂的风险。
由于HAB的少见性,是脊柱HAB,以及供血这些肿瘤的动脉的复杂解剖结构,迄今为止,其术前栓塞的经验仍然很短暂。栓塞后的大多数患者接受了肿瘤全切除,在另一个病例中,由于栓塞剂渗透到肿瘤导致肿瘤巩固,手术被证明是不可能的;病人正在接受医生的观察。
由于术前栓塞效率和相关风险的数据通常基于对使用不同材料进行的手术的回顾性分析,目前,对于髓内HAB治疗的程序可行性没有共识。一些作者认为,由于术中出血量减少、手术总时间减少以及肿瘤全切除的机会增加,手术实用性(如果没有直接禁忌症);其他人报告了与该手术相关的并发症的可能性,如硬膜内出血、脊髓缺血,以及栓塞剂轻微渗出到肿瘤、肿瘤增厚和复杂的肿瘤切除。总的来说,现有数据表明,如果没有直接禁忌症,该手术可适用于术中出血风险高的患者,以及大肿瘤患者。同时,与显微手术切除肿瘤相比,栓塞在患者神经状态变化方面没有本质优势。因此,该程序可以被视为一种能够简化手术并减少相关风险的方法,而不是一种可以好转患者术后状态的方法。
术中视频监控
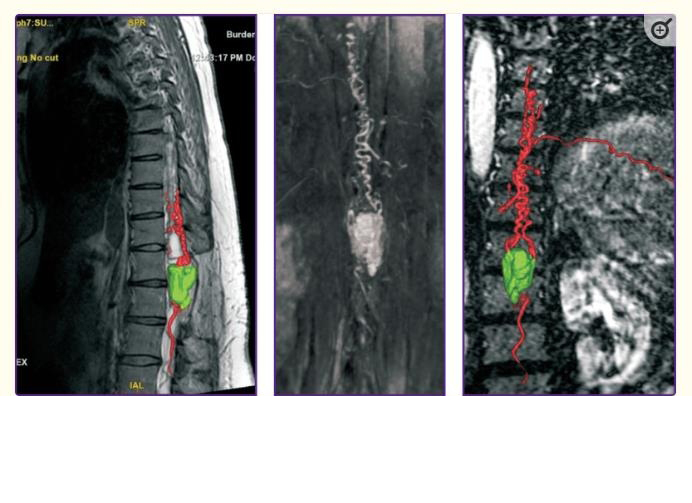
除了术中出血外,脊柱HAB切除术还有一个更严重的风险,即在成像和排除肿瘤供血动脉之前,肿瘤实体成分损伤。它可能导致大量失血,有时达到3升,以及由于长期尝试使用双较电凝止血而经常出现的长期性术后神经损伤。因此,明确识别供血动脉和引流静脉,以及在切除前排除动脉供应是顺利和完全(整体)切除的必要条件。该问题的可能解决方案之一是使用吲哚菁绿视频血管造影(ICG-VA)进行术中视频监控(图5)。ICG-VA一开始开始用于眼科血管造影,是在上世纪70年代中期。之后,该技术被用于其他研究,包括动脉瘤和脑肿瘤手术。自2011年以来,与ICG-VA使用相关的出版物数量开始呈指数增长,然而,目前,关于ICG-VA在脊髓髓内肿瘤手术中合适应用的研究很少。发现该技术能够控制髓内HAB全切除。在С7–Th2水平下切除实体肿瘤成分时,对肿瘤供血血管进行成像合适。此外,使用ICG-VA可以在Th12水平上显示背侧HAB血管,并控制其完全切除。
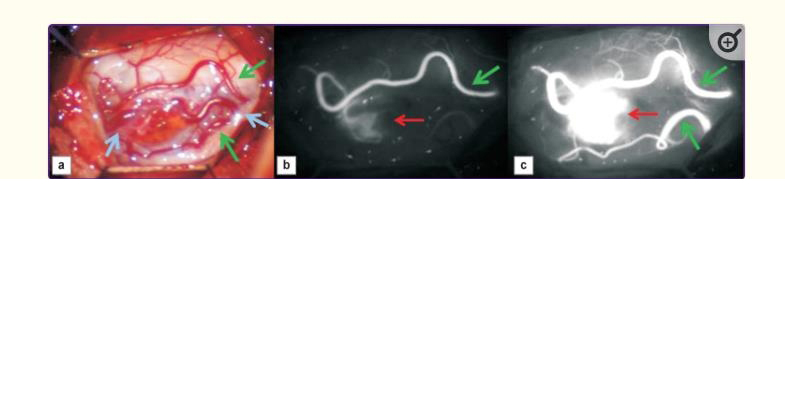
利用术前、术中和术后图像的对比分析结果,作者成功定位了5名患者的供血动脉和引流静脉,以及肿瘤边界。在其他患者中,有一例残留的离断血管肿瘤位于脊髓实质深处,无法成像;在二个病例中,由于腹外侧肿瘤位于脊髓实质下方,只能看到引流静脉。进行的手术使7个肿瘤中的6个完全切除,7个部分切除,未发现任何患者有必要的术后神经损伤。因此,在腹侧和深部肿瘤的情况下,ICG-VA的能力是有限的。
使用吲哚青绿的术中视频血管造影在HAB手术中是一种有用的工具,可以实时成像肿瘤本身及其供血和引流血管;此外,它可以避免过度失血和肿瘤不完全切除。然而,在决定方法的适用性时,应考虑位于实体瘤组件内的供血动脉的成像复杂性。大多数HAB位于脊髓背表面。因此,使用ICG-VA对其供血动脉进行成像不是一个复杂的问题。对于位于脊髓腹侧表面的肿瘤,供血来自脊髓前动脉池的动脉。在这种情况下,ICG-VA的使用几乎不会影响供血血管的成像程度以及肿瘤本身。此外,如果手术中未完全切除的肿瘤碎片被发现是断流的,该方法无法提供检测它们的机会;在这种情况下,需要使用MRI或术中超声检查。
结论
由于血管母细胞瘤的血管化程度较高,在某些情况下,为了诊断和鉴别脊柱肿瘤,除了MRI外,还可以使用灌注计算机断层扫描等技术(对于肿瘤实体结构,为了将血管母细胞瘤与其他髓内脊髓肿瘤进行鉴别诊断,以排除脱髓鞘疾病),计算机断层血管造影(用于识别和表征血管母细胞瘤节点,对肿瘤和供血血管进行成像)和磁共振血管造影(用于区分血管母细胞瘤和其他血管畸形,并对通过肿瘤的血流进行成像)。脊髓血管母细胞瘤的手术切除可伴随术前栓塞,以减少术中出血风险,因为栓塞可确保相对较低的术中风险。尽管不同研究人员对并发症风险存在不同的观点,但他们报告的结果表明,对于大肿瘤和术中出血风险高的情况,可以采用该手术。术中成像是一种很有前景的方法,使用吲哚青绿显示肿瘤及其供血血管,在肿瘤全切除过程中提供可检查性,并清晰显示其血管构筑;它有助于减少手术失血。




