胶质瘤恶变这是其病理及分子基因组学本身的一大特点,此外有临床经验及研究表明放疗也有诱发胶质瘤恶变的可能(不过这种情况存在的很少),看看如下目前指南版本的胶质瘤诊断流程,可以明显清楚地看出不同胶质瘤转化、恶变的情况。
脑胶质瘤分子诊断流程
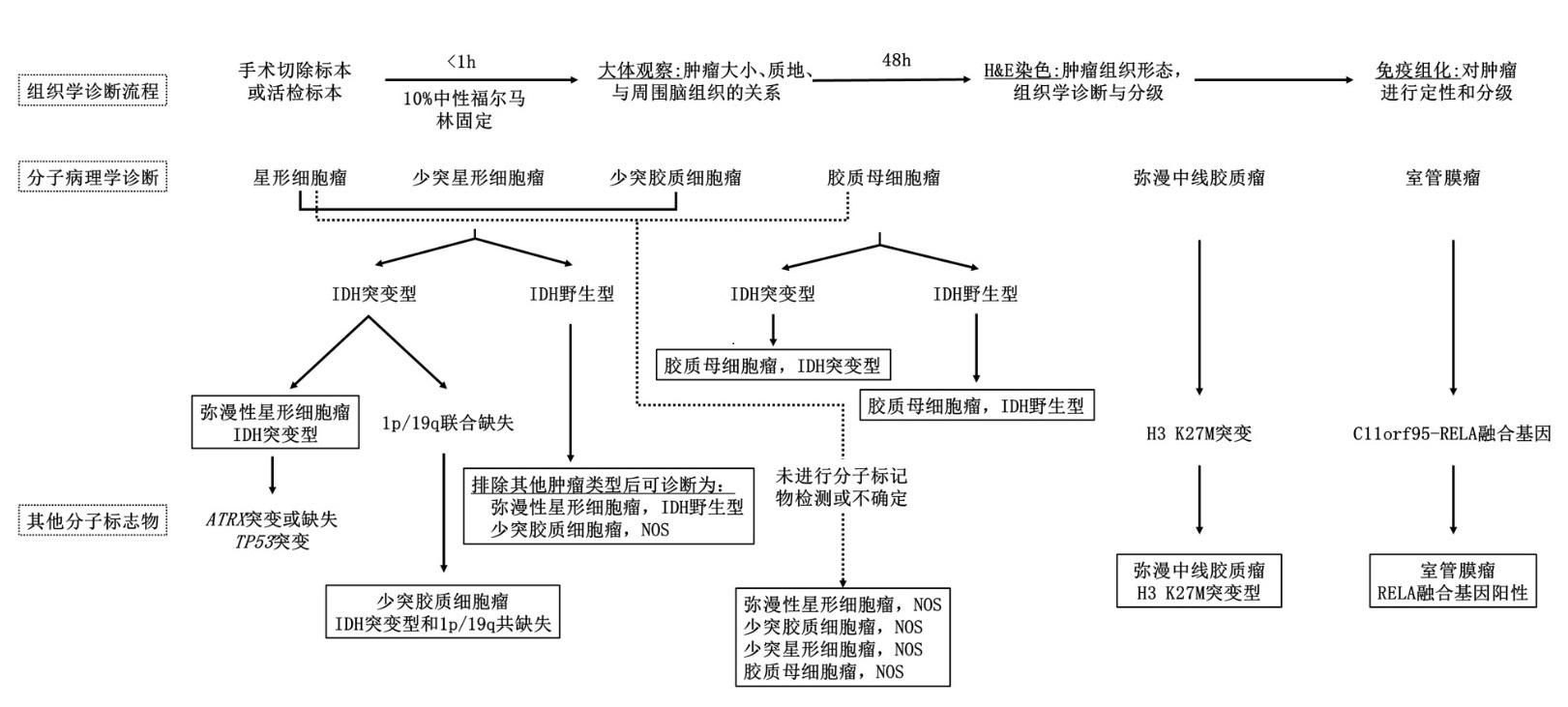
神经胶质瘤是一种起源于大脑或脊柱神经胶质细胞的肿瘤。胶质瘤约占全部脑肿瘤和中枢神经系统肿瘤的30%,占全部恶性脑肿瘤的80%。胶质瘤根据核分裂像、异型性、细胞增殖速度进行分级,胶质瘤根据核分裂像、异型性、细胞增殖速度进行分级,1级和2级一般称低级别胶质瘤,通常具有更好的预后结局。
3级和4级胶质瘤被认为是高级别胶质瘤,未分化或间变性,预后较差。胶质瘤2级虽扩散浸润,但属于低级别胶质瘤。虽然胶质瘤2级和胶质瘤1级同属于低级别胶质瘤,但是预后差距却很大。不考虑任何分子亚类,胶质瘤2级,治愈率一般来说,5年生存率达40%-80%,中位生存期在3-5年。当然不同的研究,生存率可能会有点差距。
低度浸润性胶质瘤(低级别胶质瘤;WHO二级)部分会进展为高级别胶质瘤(WHO三级和四级)。少突胶质细胞瘤占5%,星形细胞瘤占17.4%,其余被归类为少突星形细胞瘤。胶质瘤转移和等级恶化通常是由多种因素决定的,疾病病理、切除情况、术后辅助治疗情况等。
原本是二级的少突胶质细胞瘤,为什么一年多就发展到了4级?临床上这样的案例多见,关于这一点,从病理学层面来说,可以总结为以下两大原因:
1、病理学/IHC
低级别胶质瘤的基本组织学分类是基于星形胶质细胞或少突胶质细胞分化的细胞学评估。在少突及星形胶质瘤全部的类型中,与非肿瘤细胞相比,除了核异型性之外,还存在无明显肿瘤边界的弥漫性浸润。单个肿瘤细胞可能显示核不规则性(在星形细胞瘤的情况下)或核周透明的圆形核(在少突胶质细胞瘤的情况下)。一些肿瘤显示细胞形态的混合,导致了少突星形细胞瘤。

基于的TCGA数据的胶质瘤发生恶变进展的方式《癌症基因组图集》
临床上,大多数弥漫性星形细胞瘤分化良好且生长缓慢,手术切除后常有复发的趋势,部分可进展为更高级别的胶质瘤。少突胶质细胞瘤通常进展更为惰性;然而,这些病变也较终发展成更高级别的病变。对于胶质瘤预后的判断,不仅仅局限于少突胶质瘤这一类型的区分,更详细的可以深入到少突胶质瘤具体的分子和细胞遗传学特征。
胶质纤维酸性蛋白(GFAP)的免疫组织化学染色通常可以确认胶质来源。使用抗体对有丝分裂活性进行免疫组织化学染色MIB-1也可以用来验证低增殖指数。p53的额外染色可有助于将病变指定为肿瘤性神经胶质过程,并且在星形细胞肿瘤中更常见为阳性。目前,这些标准被用于对国际卫生组织二级胶质瘤进行较终病理诊断。需考虑基于分子和遗传变化的进一步分层,以提高临床医生确定预后和治疗过程的能力。
2、遗传学和分子标记
对过去五年文献的回顾表明,越来越多的人认为诊断为低级别胶质瘤的患者应根据1p/19q编码和IDH突变状态分为两组。从基因上来说,低级别胶质瘤包含IDH170-80%的病例出现突变。此外TP53在大约60%的星形细胞瘤中发现突变,而超过70%的组织学定义的少突胶质细胞瘤显示1p/19q的共病变。混合少突星形细胞瘤携带TP53突变或1p/19q共缺失,因为这些改变大部分是相互排斥的。在回顾性和前瞻性试验中,IDH突变和1p/19q共缺失已被广泛研究,并显示与预后好转相关。
成人浸润性低级别的检查需要确定其为星形胶质细胞或少突胶质细胞肿瘤的性质。除了上面讨论的组织学发现,分子和细胞遗传学特征的测试可以帮助分类,并为患者和治疗临床医生提供额外的信息。更重要的是肿瘤IDH突变状态的定义,这可以通过IHC(常见的突变蛋白质产物)或分子方法。其次,对浸润性神经胶质瘤中1p/19q共缺失的描述提供了少突胶质细胞瘤的细胞遗传学证据,并将该肿瘤归入具有预后和评估相关性的不同类别。三,识别一个ATRX或者TP53突变支持肿瘤是浸润性星形细胞瘤的解释,因为这些异常在少突胶质细胞瘤中很少见。分子特征分析显示,成人浸润性星形细胞瘤ATRX和TP53突变通常与IDH突变和行为比IDH野生型星形细胞瘤。除了IHC之外,使用IHC检测或下一代测序可以帮助识别这些突变。

较终,我们可以对低级别胶质瘤患者进行分层:IDH突变的1p/19q共缺失患者和IDH突变或未突变的1p/19q完整患者(1p/19q共缺失几乎总是与IDH突变相关)。那些1p/19q共缺失的患者被诊断为少突胶质细胞瘤,据信这种共缺失较终将成为少突胶质细胞瘤诊断的一项要求。结合1p/19q评估,使用TP53和ATRX评估可能允许对被认为与组织学参数混合的肿瘤(少突星形细胞瘤)进行明确的分子分类。
在临床实践中,没有染色体1p19q编码的少突胶质细胞瘤患者可能需要在更短的时间间隔内进行更密切的系列影像成像(核磁)随访。与肿瘤中存在IDH突变的患者相比,无IDH突变的WHO二级星形细胞瘤患者易于更快地转化为更高级别的肿瘤。这些患者往往预后较差。
为什么胶质瘤治疗会失败?
如果排除WHO1级胶质瘤,常规治疗将无法治愈大部分WHO胶质瘤。治疗失败的原因是这些肿瘤在诊断之前都已侵入大脑,即胶质瘤细胞的侵袭性质,这是当前胶质瘤难以治疗的重要因素。在观察、切除或放疗后,这些静止的细胞中有一些后来转变为更恶性的表型。低级别胶质瘤通过转化为恶性胶质瘤的遗传目录的进展被很好地记录下来。不幸的是,人们对这些转变的触发因素和时机知之甚少。此外,目前还没有已知的治疗可以延迟或停止这种遗传去分化。关于胶质瘤预后可控因素中,胶质瘤的手术治疗是应该首要关心的。
手术是获得组织学诊断和获得有价值的分子信息的必经之路。对于2级胶质瘤,在可能的情况下应尽早切除,而不是等待观察。手术切除应尽可能广泛,术中影像学技术,连续电生理监测和清醒手术尽量减少手术风险。手术切除的程度与无进展生存期(PFS)和总生存期(OS)相关:接受全切除的患者比接受部分切除或活检的患者生存时间更长。尽管我们还没有对低级别胶质瘤患者进行随机对照试验,但这一观察结果在全部研究中都是一致的。肿瘤的生物学特性可能影响其可切除性:idh突变的胶质瘤可能更容易进行根治性切除,浸润性更小。由于扩大切除的有利影响,一些作者鼓励行癌前切除术(即超出可见的肿瘤边缘)。除了增加病人的存活率外,手术切除还可以好转癫痫发作的控制。
在间变性胶质瘤中,尽可能的切除是标准治疗,使用5-氨基乙酰丙酸的荧光引导手术可能有助于切除间变性灶。减轻大肿瘤患者的肿块效应和减少后续照射的肿瘤体积也可能是重要的。由于全部这些原因,手术在2级胶质瘤中有较大的意义,患者应转介给专门治疗弥漫性胶质瘤的神经外科医生。
并不是全部的弥漫性胶质瘤都无法切除干净,儿童的小脑星形细胞瘤可以切除干净,成人限于额叶、颞叶的1级星形胶质瘤也可以完全切除,很多复杂的位置的胶质瘤对于经验丰富的术者也可以顺利全切。说白了,就是这个肿瘤的恶性程度较低,并且生长的位置又要适合于扩大切除,切掉后病人还不会发生严重并发症——这几项的组合是完全切除肿瘤的必要条件——大脑密布阡陌交错的神经与血管,因此想要完全切除困难。因而,即使神经外科显微技术已经有了长足的发展,对于神经外科医生的要求丝毫没有降低。胶质瘤切不干净的必然结果就是残存的肿瘤再生长,并有可能进入恶性进展过程。
对于胶质瘤转移到脊髓,这是因为肿瘤可以在同一部位或附近复发(局部复发),也可以在远端部位复发。远端部位(远端复发),任意定义为距原始肿瘤部位2 cm以上。尸检研究表明,放疗在某种程度上控制了局部疾病(50%的病例在原发部位没有复发),但远处复发的发生率从无放疗的3%增加到有放疗的19%至22%。
胶质瘤患者想要提高预后,除了尽量切除干净外,常见的治疗方案包括放疗,化疗和联合方法也要根据情况选用。在2级胶质瘤中,系统辅助治疗与延迟放疗并不能提高生存率。因此,对于年龄小于40岁的WHO 2级胶质瘤患者,一致认为应进行严格的影像学随访(即每3个月进行一次MRI扫描),无需辅助治疗。辅助治疗通常用于手术后残留肿瘤和/或不良预后特征的患者(如年龄为>40岁,神经功能障碍,癫痫发作失控)。




