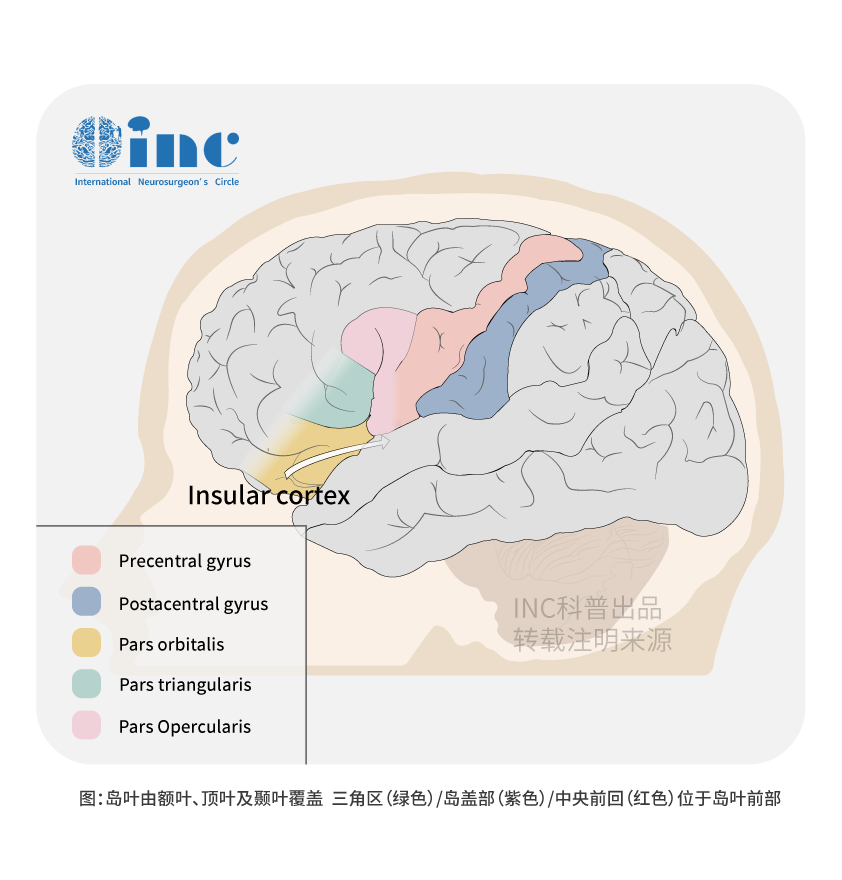
岛叶的解剖解构
岛叶功能区域内包含语言和运动功能通路以及它们的微血管供应。外侧裂周围语言网络覆盖在岛叶皮质表面,而钩状束和额下枕状束则延伸至岛叶更深的皮层下区。岛叶内侧是基底神经节和内囊,以及横贯纹状囊动脉。虽然短的M2穿支供应岛叶,可以被牺牲,但它们需与长的M2穿支区分开来,后者穿过岛叶区域到辐射冠,供应皮质脊髓束下行。
图1
对于脑岛的手术入路来说,尊重该区域的功能皮层、连通性和微血管是至关重要的。岛叶胶质瘤的Berger-Sanai分类是在这些解剖学考虑的基础上提出的。岛叶被分为四个区域,前后边界由一条平分Monro孔的线界定,上下边界由Sylvian裂界定(图1)。这种分类方案允许评估岛叶胶质瘤与其相关的功能解剖,如Sylvian周围语言网络(I-III区),初级运动和感觉区(II区),heschl氏回(III区),深纹状囊动脉(IV区)。Berger-Sanai分类已被证明可以评估提高采收率和手术发病率。
岛叶区域内的功能连通性
脑岛在各种各样的边缘、感觉和认知模式中都有牵连。与岛叶的喙侧-腹侧分叶皮质的连接包括杏仁核、扣带皮层和眼窝额叶皮层,这表明它在情绪和嗅觉功能中发挥作用。背侧新皮层参与感觉功能,接收大量丘脑和皮层的味觉、体感和副感觉传入信号。此外,身体感觉(饥饿、疼痛、口渴等)的丘脑传入在岛叶皮层中按地形组织,与对照组相比,左侧岛叶胶质瘤患者的心率变异性明显更大,这表明其在自主感觉输入整合中发挥了作用。较后,脑岛的分离区被认为与认知功能有关,如注意力、记忆和语言处理。目前尚不清楚岛叶胶质瘤患者是否会因为这些感觉传入皮层下区域的肿瘤而经历持久的神经功能缺损。岛叶胶质瘤的手术入路
经外侧裂入路
Yasargil等人于1992年对240例边缘和边缘系统肿瘤的经外侧入路进行了研究。提出岛状胶质瘤通常尊重边缘系统的解剖边界,而不会侵入深部新皮质结构的概念。因此,尽管早期报道该区域的肿瘤难以切除,Yasargil在的手术治疗后取得了良好的长期发病率5%。在当前的神经外科时代,显微外科技术和皮质定位技术的进步继续提高了岛叶胶质瘤切除术的顺利性。较近一项对890例岛状胶质瘤患者的病情分析发现,手术后新的长期性运动障碍和语言障碍的综合发生率分别为4%和2%。跨外侧裂入路
通常进行广泛的外侧裂劈开,以完全暴露岛叶区域。Potts等人建议将裂隙分为两部分,分为前段和后段。前裂从远侧到近侧,继皮质动脉到盖动脉,再到大脑中动脉分叉处底部的M2节段。这种解剖通过MCA血管的几个窗口暴露岛叶的前部。然后,后裂从近端向远端进行。正如Safaee等人所详细描述的那样,随着外侧池向后结束,额颞骨盖附着在软脑膜边缘,这种解剖变得更加困难。由于空间和手术定位的限制,后裂可能需要固定回缩或牺牲外侧浅静脉的协助(图2)。然而,经外侧裂入路的一个关键优势是保留了优势半球的额叶和颞叶盖,从而较大限度地降低了手术直接损伤语言网络的风险。在现代系列中,经外侧裂入路治疗岛叶胶质瘤后的长期神经系统发病率为9%至11%。
图2
随着术中监测技术的发展,经皮质入路进入岛叶已获得普及,可对岛叶胶质瘤进行明确定位和影像识别。对于较大的胶质瘤,通过非功能皮质形成多个皮质窗口,并在切除腔内水平连接,保留功能皮质和上部的关键Sylvian血管(图3)。
图3
通常,切口和开颅手术是根据胶质瘤的大小和位置量身定制的。优势半球皮质刺激可能会产生语言功能的“阳性”和“阴性”部位,但更集中的暴露可能只会产生“消较”结果。在对250名接受优势半球脑胶质瘤清醒切除术的患者的分析中,3281个(94.3%)皮层刺激位点中有3094个为阴性,105个(42%)患者的语言“阳性”位点为零。在有“阴性”结果的患者中,胶质瘤切除通过假定的无功能皮质进行。使用这种“负标测”策略,1年内语言功能恶化的比率仍然很低(1.6%),表明即使在没有确定“阳性”语言部位的情况下,集中暴露优势半球,也可以在没有语言缺陷的情况下切除大多数脑胶质瘤。这项技术遵循的假设是,语言通路垂直于其皮质起源部位下降,因此,削弱“消较”皮质部位是顺利的。自那时以来,皮层下语言标测技术不断发展,经验丰富的标测外科医生已成功识别出重要的皮层下语言束,如弓状束和额枕下束。虽然经皮质入路存在直接手术损伤功能组织的风险,但在较近的一系列研究中,标测技术的进步导致神经系统发病率较低(3-9%)。
手术方法及技巧
1.肿瘤暴露:由于肿瘤深埋在岛盖中,目前手术多采用翼点或者改良翼点入路,经外侧裂暴露肿瘤。切除岛叶胶质瘤一般采取以下步骤:常规切开硬膜,硬膜基底位 于眶部;分离外侧裂一般为6-7cm,广泛开放外侧裂易于显露环岛沟、整个大脑中动脉及全部的M2分支;打开外侧裂时,侧裂的浅静脉系统走行及变异较大,保 护引流静脉和保护动脉同等重要,术者在制定手术计划以及在手术操作中都应当重视静脉系统,做到心中有数 。暴露大脑中动脉。随着外侧裂的分离,大 脑中动脉也逐渐暴露,在切除肿瘤过程中,需显露和确定可能被肿瘤包裹的M2分支,以确定和切断起源于M2深面的短穿支,需暴露大脑中动脉和从M2段到环岛沟的全部分支,沿着M2段的多个分支显露额盖和颞盖,这样在切除肿瘤时可以尽量减少无意损伤。2.肿瘤的切除:手术操作通过一个宽15mm,长4cm的间隙来切除,可按以下先后来切除肿瘤:肿瘤中心区域、颞盖下肿瘤的切除、额顶盖下肿瘤的切除、后部肿瘤的切除、内侧部分切除。不适当的牵拉优势侧额叶可引起运动和语言功能障碍,同样对优势侧颞叶后部的牵拉也可引起语言功能 的障碍。Yasargil完全不用脑压板,而用牵引和棉球来保持侧裂的牵开;额盖,肿瘤向额盖或颞盖扩张者,也可采用此种方法,这种方法使侧裂的切开变得 相当方便,也增加了侧裂窝的显露,可以合适地切除岛叶部分的肿瘤 。
3.血供的阻断:从大脑中动脉的M2(岛叶段)段表面发出许多小的穿动脉,为岛叶肿瘤的血供,每根穿支血管都应电凝切断,以阻断肿瘤血供,否则即便是血管主干保留,这种操作也可能使大脑中动脉术后发生痉挛,引起术后神经功能缺失。岛叶肿瘤的内侧面可包裹外侧豆纹动脉,电凝这些血管可引起内囊和基底 节区梗死而导致术后偏瘫,避免损伤这些血管的方法是尽早显露较外侧的豆纹动脉并加以保护,用这些血管的行程以及环岛沟的基底部来标定肿瘤切除的深面。M2分支的后部发出长穿支是供应放射冠和皮质脊髓束纤维的关键血管,其损伤是引起运动纤维损伤的另一原因,因此全部粗的穿动脉是起源于M2段分 支在岛叶后部的血管以及不是逐渐变细的血管都应当保护好。
手术辅助技术
在切除岛叶胶质瘤手术过程中我们可适当使用辅助技术和技巧,包括唤醒麻醉、神经导航、术中超声、诱发电位以及皮质电刺激等。1.功能辅助:在切除优势半球岛叶胶质瘤时可采用唤醒开颅,在术中可评价脑部各功能区;
2.定位辅助:术中肿瘤定位技术已进展到无框架立体定向和术中超声,但是都不能代替细致的手术分离技术。
手术切除程度及预后
目前全部资料均显示,手术全切除肿瘤是提高病人生存质量和长期存活的较佳治疗,是化疗、放疗所不能代替的。较近的研究显示,岛叶胶质瘤的中位切除程度为81-86%,切除程度达90%以上的WHO Ⅱ级肿瘤患者5年生存率为全切,切除程度小于90%的患者5年生存率84%。不同切除程度的WHO Ⅲ、Ⅳ级岛叶胶质瘤患者5年生存率由91%降至75%。肿瘤切除程度是WHO Ⅱ-Ⅳ级岛叶胶质瘤总体生存期与无进展生存期的评估因素;切除程度低的患者容易发生恶变,肿瘤复发时应当及时手术。唤醒手术中,皮质及皮质下脑电图监测可以降低术后长期性神经功能缺损率。除此之外,3D超声导航、高分辨术中磁共振等辅助技术也可以降低术后并发症发生率。WHO Ⅲ-Ⅳ级胶质瘤的长期神经功能缺损发生率高于WHO Ⅱ级胶质瘤;短期神经功能缺损较常发生在1区胶质瘤以及涉及4个区域的较大岛叶胶质瘤。
岛叶胶质瘤手术治疗总结
岛叶毗邻重要功能区和血管,顺利切除岛叶胶质瘤充满挑战。在过去20年,通过神经外科医生、麻醉师、神经科学家和解剖学家的共同努力,人们对大脑解剖和功能的理解上升到新的高度;微创外科技术的发展、唤醒麻醉、语言和运动区脑电监测技术应用,为好转患者预后提供可能,使高、低级岛叶胶质瘤患者都可以考虑进行较大顺利范围下的切除。在患者求医过程中,如果经济条件允许,有较高生活质量要求,想获得更加预后效果,建议患者寻找有成功手术经验的医生、有前沿医疗设备的医院进行听神经瘤手术。参考文献:Surgical strategy for insular glioma,Colin J. Przybylowski, Shawn L. Hervey-Jumper, Nader Sanai J Neurooncol. Author manuscript; available in PMC 2021 Mar 31.Published in final edited form as: J Neurooncol. 2021 Feb; 151(3): 491–497. Published online 2021 Feb 21. doi: 10.1007/s11060-020-03499-4




