感谢你们的盛情邀请,能与这些可敬的同事们一起在这个美妙的场所共聚一堂,我深感荣幸
——INC瑞典Tiit Mathiesen教授
欧洲神经外科教授教授
北欧神经外科一人
2023年11月25日,INC国际神经外科医生集团“三届国际神经外科顾问团云端峰会”于中国一高楼,被誉为“上海之巅”的上海中心大厦的J酒店开幕。时隔四年,INC旗下国际神经外科顾问团(WANG)十多位成员教授再度聚首上海,以“Neurosurgery is art”为主题,与国内专家共话神外美学!近百位国内神经外科专家受邀参会,见证了这场云集多位国际“教授”专家的国际神经外科界较高规格的学术盛宴。
INC国际神经外科医生集团旗下组织国际神经外科顾问团(WANG)成员、国际神经外科联合会(WFNS)伦理委员会主席、丹麦哥本哈根大学神经外科教授——Tiit Mathiesen教授(瑞典)同参会的国内外神外医生们交流了“Meningioma-extent of resection,recurrence and PET imaging(脑膜瘤的切除率、复发及PET影像学研究)“这一学术课题。

90%以上的脑膜瘤都是良性,良性脑膜瘤即便长在复杂位置,只要做到顺利全切,5到20年可能都不会复发,可以延长生存期,甚至达到治愈效果。如果切不干净,短则3个月到半年就会复发,长则1年到3年不等,因此切除率是预后的主要影响因素。
Simpson分类是目前常用的脑膜瘤分类方法,应用于脑膜瘤的预后有很好的评价。Simpson分类越低,脑膜瘤的复发率越低。随着现代技术的出现,包括术前和术后成像、显微外科和内镜技术、前沿的组织病理学和分子分析以及辅助放疗,Simpson分级量表在评估脑膜瘤切除术后复发方面的效用已经受到质疑。那脑膜瘤复发受哪些因素影响呢?脑膜瘤的切除率又应该如何评估呢?一起来看看欧洲神经外科教授——Tiit Mathiesen教授的相关研究。

瑞典Tiit Mathiesen教授
▪丹麦哥本哈根大学神经外科教授,高级顾问,2017年至今;
▪欧洲神经外科协会会官方杂志Acta Neurochirurgica主编,2015年至今;
▪国际神经外科联合会瑞典医学会伦理委员会现任主席,2013年至今;
▪国际神经外科联合会颅底手术教育中心主任,2009-2016年。
擅长领域:脑膜瘤、脑海绵状血管瘤、三脑室病变、颅底和血管手术、个体化和组合式显微放射外科手术。
Tiit Mathiesen教授课题讲解全记录
感谢你们的盛情邀请,能与这些可敬的同事们一起在这个美妙的场所共聚一堂,我深感荣幸

良性的脑膜瘤是否也难逃复发的魔咒?
脑膜瘤是一种慢性疾病,我们从对患者的随访中了解到脑膜瘤患者面临着复发,神经心理学方面的问题——疲劳,焦虑,实际上,诊断为脑膜瘤并接受随访的患者,无论是否接受过治疗都需被视为慢性病患者。我们需要解决这些问题,而这些患者面临的较重要问题之一就是复发风险。
20世纪中期以前,对于脑膜瘤生物学特征及影响其复发的许多因素,全国际还未有足够了解及统一认识。此后经过许多相关研究验证,较大水平的顺利切除脑膜瘤可延长无进展生存期且不增加并发症率,确定了现在国际通行的颅内脑膜瘤手术切除程度Simpson分级系统。
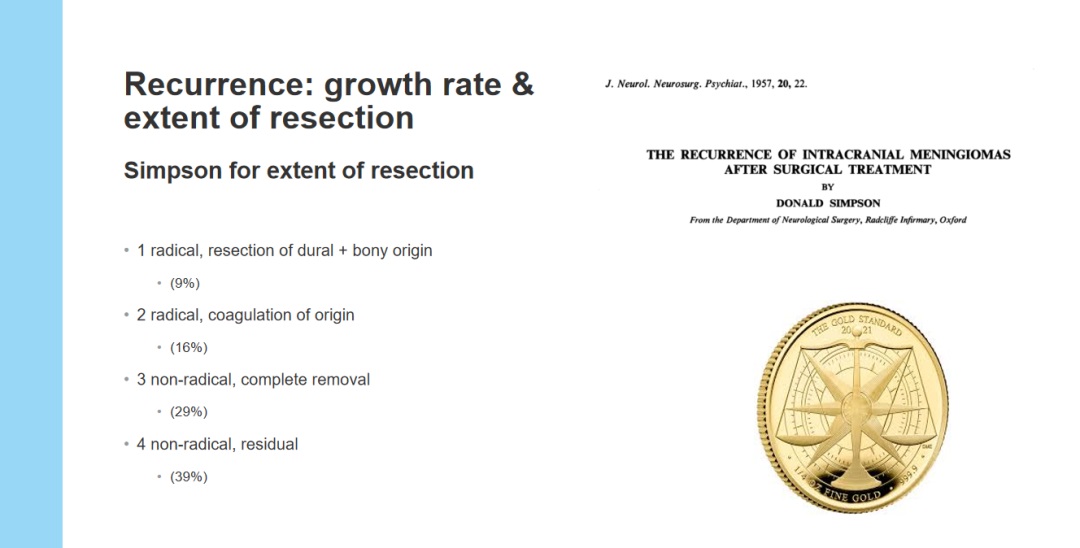
图:现国际通行的Simpson分级评估脑膜瘤复发的关系
什么是辛普森分级?目前辛普森分级存在的争议?
66年前,辛普森(Simpson)发表了关于切除范围的分级,这可能仍然是较重要的分级法,而辛普森分级的随访系统并不严谨。他的想法是,在5年、10年或类似的时间内辛普森分级较完全的患者复发风险约为10%。对于有残余的肿瘤,大多数肿瘤会在长期随访过程中再次生长。
而辛普森分级另一争议点在于它诞生于66年前,那时候还没有扫描技术,切除程度评估具有局限性。Tech Schwartz和Mike McDermott在《普通神经外科》杂志上发表过相关研究,指出辛普森分级依赖于对肿瘤切除范围的术中评估存在许多主观且不可追踪的评估。随着现代神经外科的发展,目前可以通过术后几个月再次使用核磁共振扫描的方法进行监测,然而依然只能区分全切和次全切。
另外随着现代神经外科各项新兴技术创新对于一级、二级、三级复发率的差异。

辛普森分级的局限性:
1、术中对肿瘤EOR、硬脑膜凝固和去除骨质增生的评估是主观的,通常与术后影像学无关
2、未知程度的肿瘤浸润到硬膜尾和骨质增生
3、忽略了肿瘤复发的生物学潜力而不是EOR可能是复发的较大评估因素的可能性
4、忽视了现代神经外科技术创新,如显微镜、超声吸引器、高速钻头等,这些技术创新降低了I、II和III级复发率的差异
Simpson分级一级(全切)是否就意味着不会复发?
我们曾做过一项小规模研究,我们对术后送检的,侵犯较大的静脉窦的脑膜瘤样本的切除边缘进行了系统研究。结果发现,当我们认为自己已经达到了Simpson 1级根治性切除时病理学家却发现只有42%患者的脑膜瘤样本存在清晰的边界。

长期随访下的复发率会有哪些不同?
接下来的问题是,当你开始长期随访病人时。像我在瑞典或者丹麦工作得那样当地医院部门会对病人进行很好的跟踪,因此我们实际上不仅可以随访病人10年,还可以随访25年,实际上可以随访30多年。我们发现10年内Simpson 1级和2级的复发率与Simpson已经发现的复发率基本相同,但在对患者进行25年的随访时,我们发现复发率可高达40%。三分之二的复发是在随访超过10年后发生的。如果有肿瘤残瘤,复发就会提前发生。现在这只是一个小规模的研究,当然还需要更多的研究
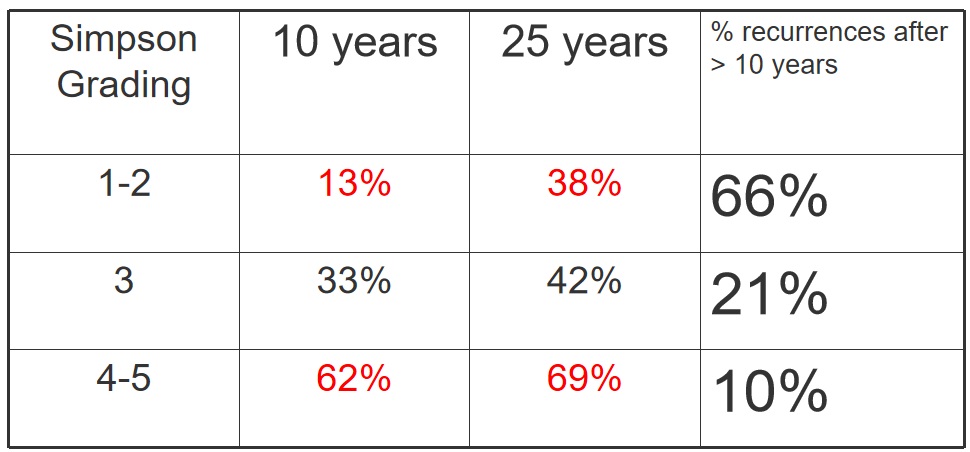
辛普森分级中的全切真的是”全切“吗?影响脑膜瘤复发的还有哪些因素?
很明显,如果肿瘤复发是因为有肿瘤细胞残留。但影响肿瘤生长的其他因素还有肿瘤大小,更重要的是细胞的生长速度。
大家对Ki67增殖指数都很熟悉,我们研究了一下这种增殖指数是否可以被看作是复发的标志物和评估因子,如果有肿瘤细胞残留,肿瘤可能会复发,但Ki67增殖指数更像是复发时间的标志。
当然,这项小型研究还需要更多的验证,我有一位博士后Christian Miriam和一位统计学家Paul Blanche Christian Miriam做了一项了不起的工作,他几乎组建了一个联盟,一次对已接受手术的脑膜瘤患者进行了多中心的登记。目前已有8000多名患者,在多中心的环境下,我们对这些患者的复发率也进行了大量的研究。我们在这里看到的是高增殖指数、低增殖指数和中等增殖指数患者的复发率。
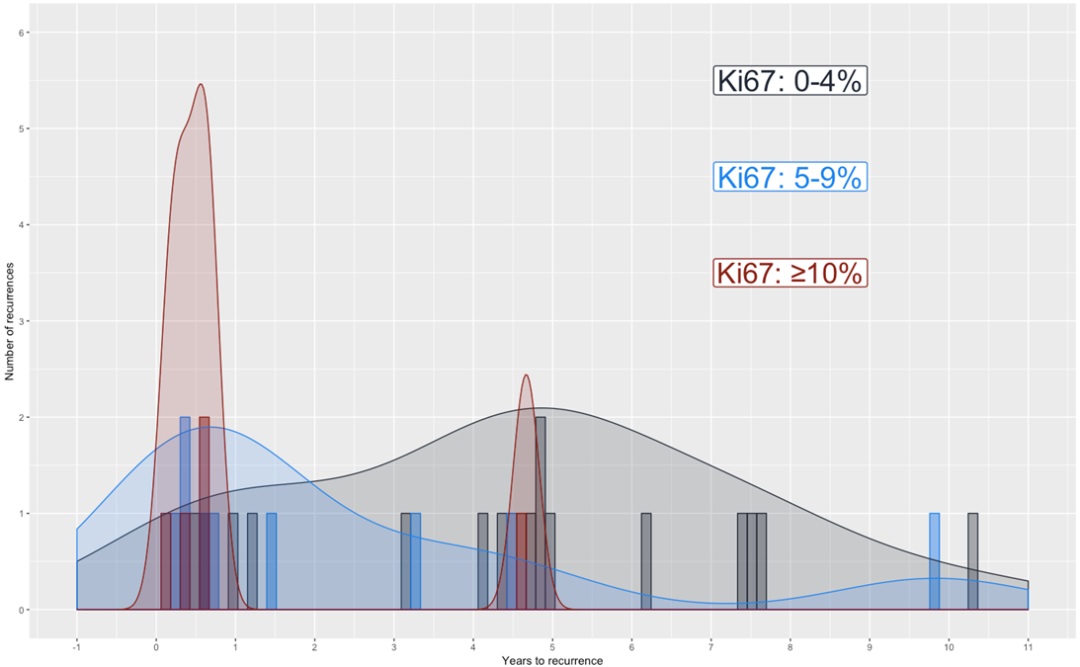
国际卫生组织1级肿瘤、2级肿瘤和3级肿瘤低增殖指数和高增殖指数根据不同的WHO级别进
行了不同的分组,但我认为这些图表说明的正是我想说的一点。
即如果有肿瘤残瘤,肿瘤迟早会复发。
如果是侵袭性较强的肿瘤,也就是WHO 3级肿瘤它们很快就会达到高峰。但如果是良性得多的1级肿瘤,当它们的Ki67指数较低或处于中等水平时,复发率是线性的,10年后的复发率约为10%。如果增殖指数越高,复发就越快,但七年后似乎会达到一个平稳期。而达到平稳期的时候,很可能全部存在残留的肿瘤都已复发。
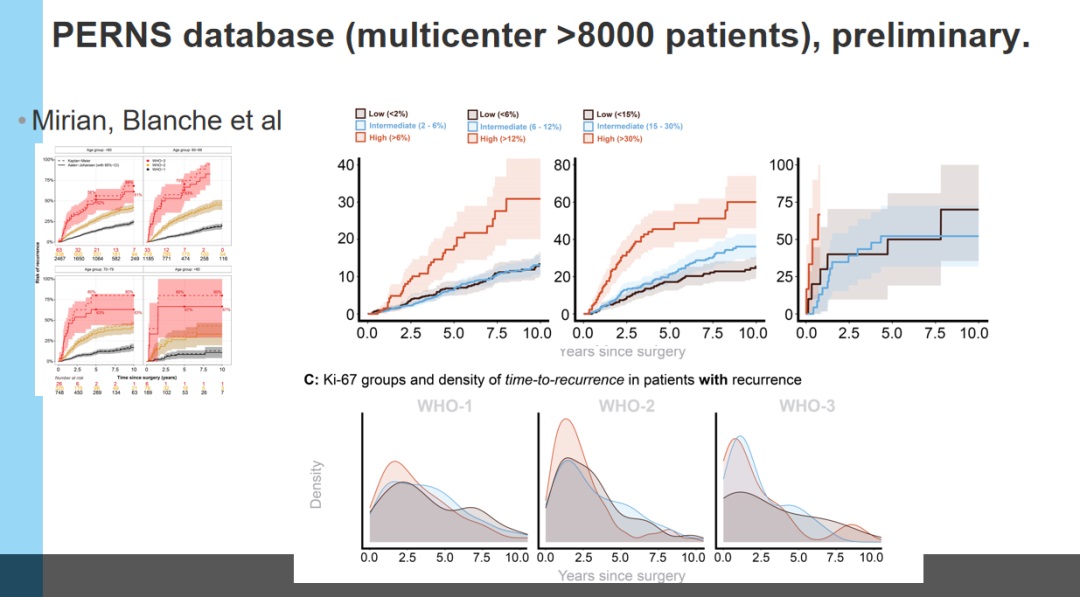
这些图表清楚地表明,Simpson 1级、2级和3级肿瘤的复发率有相当大的差异。Simpson 1级在10年后的复发率约为10%,Simpson 2级如果增殖指数较高,复发率接近40%。如果较低,复发率接近20%,Simpson 3级复发率更高。因此,通过对8000名原发性脑膜瘤患者的多中心研究。我认为这些数据表明,Simpson分级代表对肿瘤细胞残留可能性的分级。
如果有残留的细胞,可能始终存在复发的风险,我们应该对此进行更多的研究
显然,我们亟需一种可追溯的方法来确定术后是否有肿瘤细胞残留。
PET扫描——更可追溯的切除分级方法
基于核磁共振成像的分级、整合是不够的。因为大体切除可以是辛普森1级或3级,然而在肿瘤细胞残留的可能性方面存在较大差异。
现在有一种更好的方法来研究许多脑膜瘤的图像,2A型促生长激素受体的组织染色是几乎全部脑膜瘤都表达的受体,实际上,它是一种特异性脑膜瘤标记物。我们可以一种PET配体,即PET配体68镓DOTA-TOC,它可以识别促生长激素受体阳性细胞。
举例来说,术后的核磁共振成像很难看出问题,当我们将其与促生长激素受体成像相结合时,我们可以清楚地看到有残瘤。
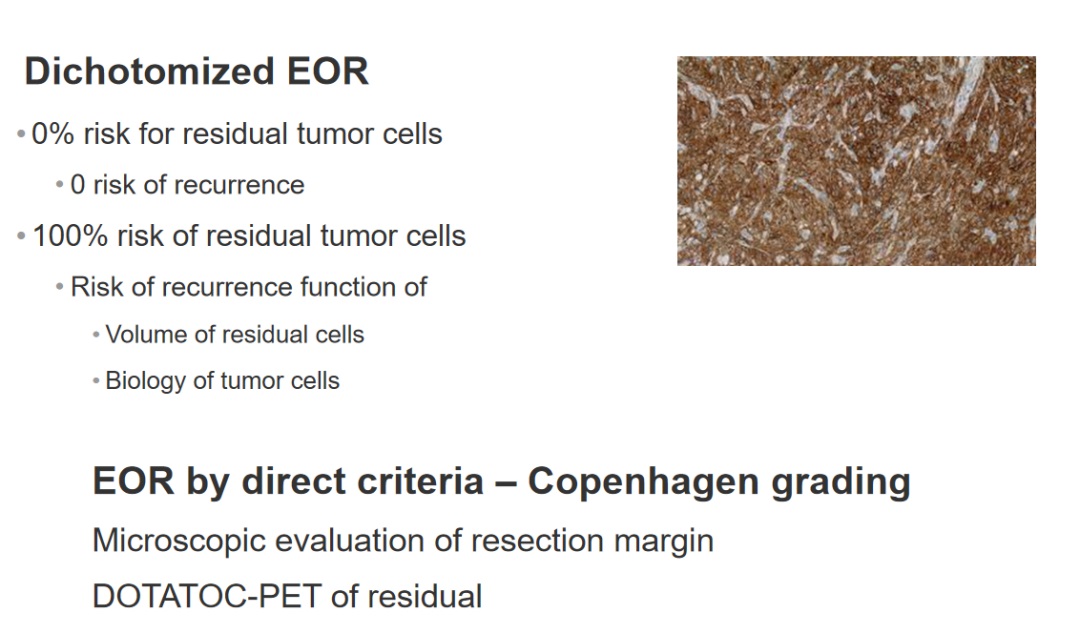
直接标准EOR——哥本哈根分级
切除边缘的显微镜评价DOTATOC-PET残留物
因此,我们科室开始使用一种不同于其他合作者的分级方法,我们都会从切除边缘处取活检组织,并在3或4个月后进行术后DOTA-TOC PET扫描,对切除边缘是否存在脑膜瘤细胞进行分级。根据是否发现脑膜瘤细胞,分级结果可能为1或0。
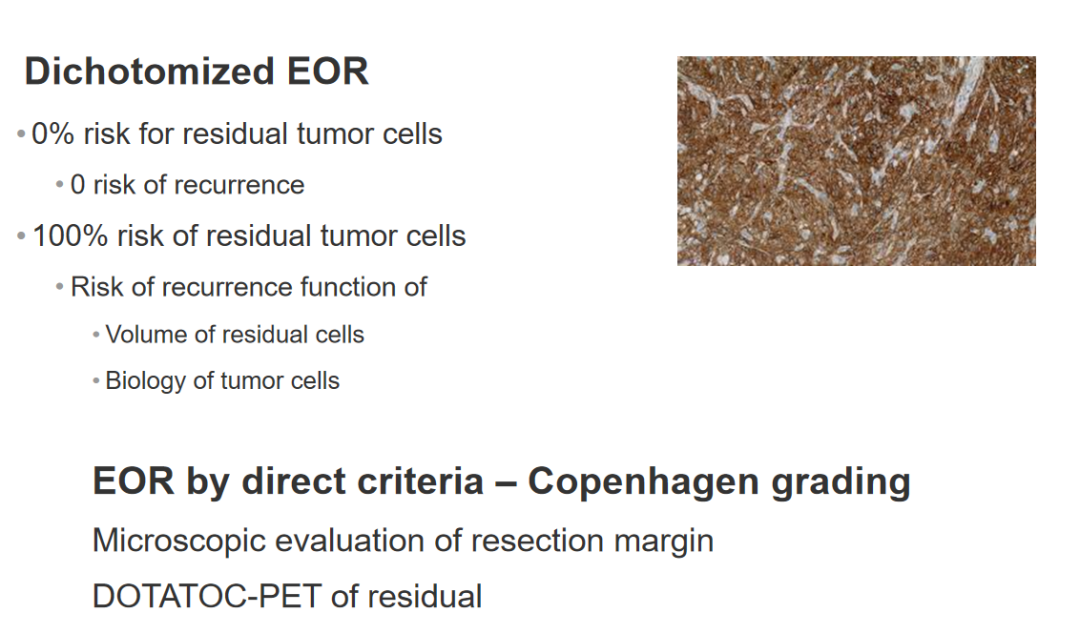
直接标准EOR——哥本哈根分级
切除边缘的显微镜评价DOTATOC-PET残留物
我们的初步数据显示,在大约五分之一的患者在我们认为达到了完全切除,并且核磁共振检查结果为阴性或不确定的情况下,我们发现有肿瘤残留的客观可追溯证据,要么是脑膜活检阳性,要么是DOTA-TOC PET阳性,当然也有一些患者两者均为阳性。
相关病人分级
因此,我们认为这是一种更可追溯的切除分级方法
常常听说的普通PET/CT是什么?
PET的各种功能显像主要依靠放射性显影剂来实行,基本上各大医院所使用的普通PET/CT,它的正电子放射性核素是18F-FDG PET/CT。这是目前临床上肿瘤诊断中较常用的放射性显影剂。恶性肿瘤糖代谢明显高于正常细胞,基于这个特性,一般情况下,如果FDG PET显示局部病灶摄取异常,则提示恶性肿瘤的存在,并且,SUV这个摄取值越高,提示恶性程度越高。
什么是检测神经内分泌肿瘤的镓Ga68 PET/CT?
PET还是那个PET,同一台仪器,但是放射性显影剂换成了Ga68-dotatate,(或dotanoc、dotatoc),是另一种正电子放射性核素。Dotatate(DOTA-octreotate)中的octreotate(奥曲肽)就是生长抑素类似物,它能与神经内分泌肿瘤表面的生长抑素受体结合。同时,Dota是镓的容器,它携带的是起到“灯泡”显像作用的68-Gallium,一种镓的同位素。这种作用原理与奥曲肽扫描类似,然而它结合了前沿的PET/CT技术,它的特异性和敏感性分别达到了全切和96%,相比CT和奥曲肽扫描,对神经内分泌肿瘤的诊断,分期以及治疗后再分期方面有较大的优势。
如果脑膜瘤有残留,应该怎么办?
我们很早以前就发表过一篇文章,与Seifert教授提出的将显微外科手术与放射外科手术相结合的想法一脉相承。既可以通过前期计划进行也可以在发现意外残留肿瘤时进行。我们称之为“定制切除加伽玛刀放射外科手术,Simpson 4级伽玛”
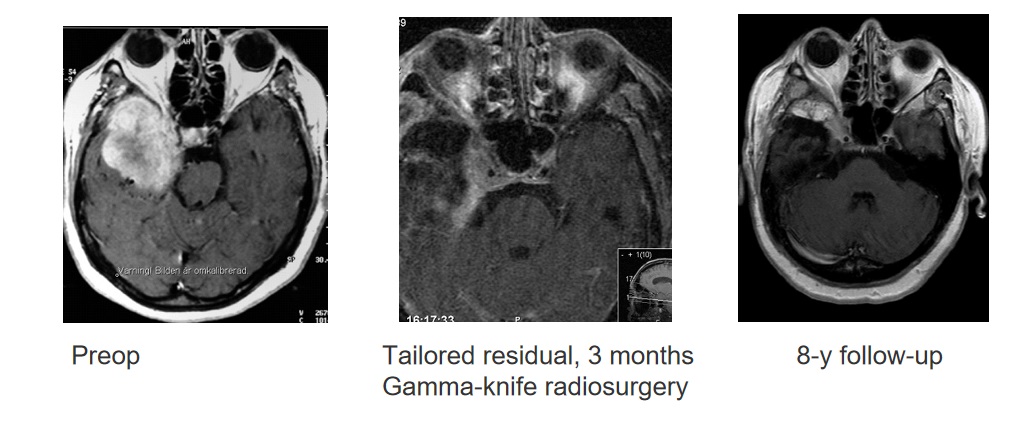
我们已经发表了一些相关结果,这些结果的独特之处在于,全部患者都接受了10年的随访,对Simpson 1到2级的岩斜膜脑膜瘤、蝶骨脑膜瘤、矢状窦旁脑膜瘤,Simpson 1到2级的复发率约为10%,控制率约为90%。Simpson 4级,即存在肿瘤残瘤,有一半或一半以上的肿瘤在10年的随访中仍在继续生长,如果我们先用放射外科手术对其进行治疗,控制率与1级相同。
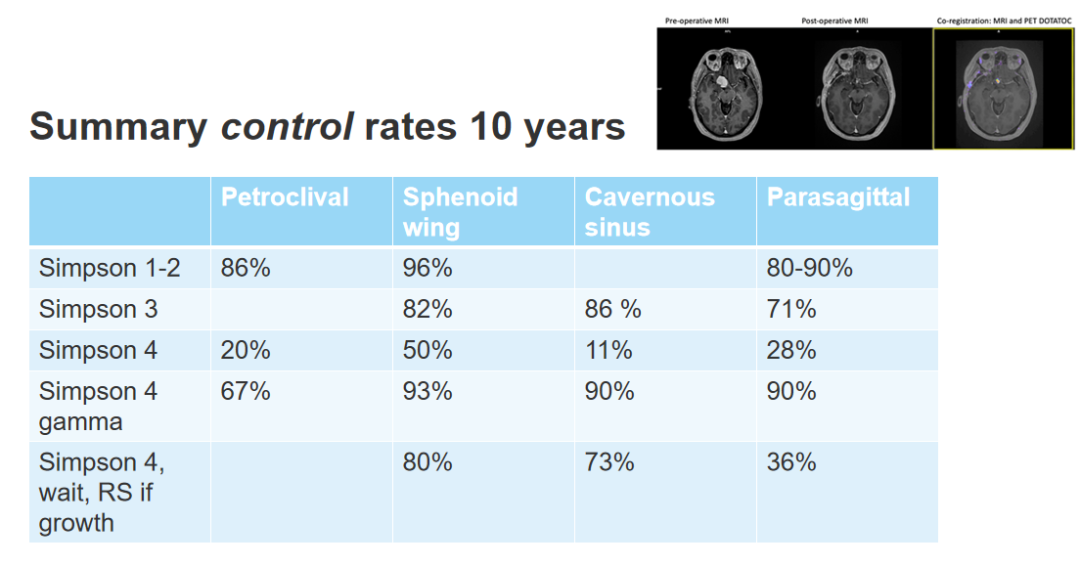
讨论:关于Simpson分级过时了吗?
还有人提出Simpson分级是过时的,有论文称不同Simpson分级的复发率是相似的,但这只适用于小样本和短期随访,还有人提出,核磁共振成像可以被取代,Simpson分级完全可以被基于核磁共振成像的定义的全切和次全切取代,另外Simpson分级1至3级都等于大体全切,这也是一个很大的问题。因此,可以在中国对脑膜瘤患者进行PET CT检查,对于有需求的患者。
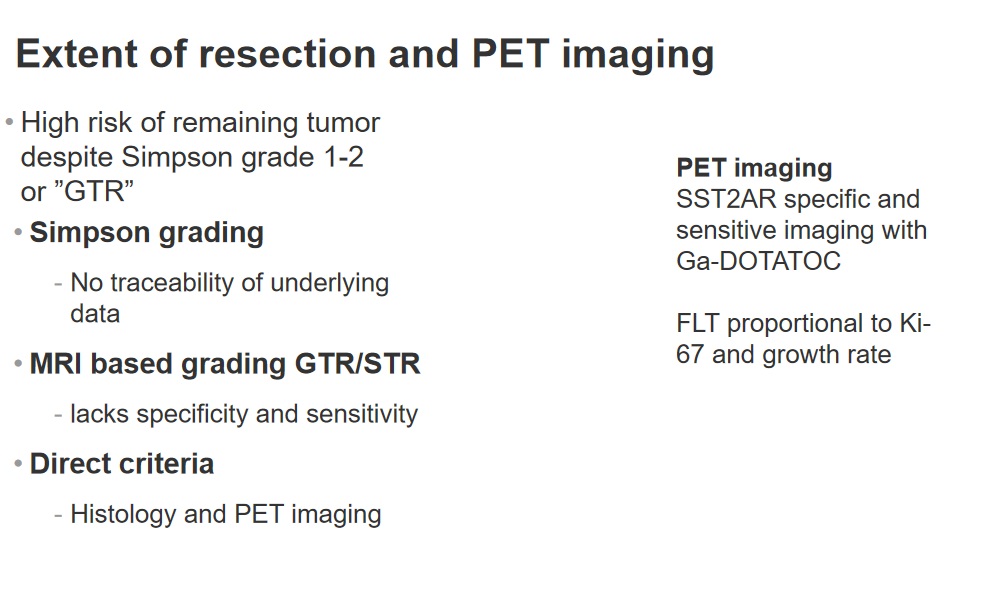
Simpson分级存在问题,因为基础数据是无法追踪的,基于磁共振成像的分级缺乏特异性和敏感性。我们提出了组织学和PET成像,我认为如果我们能普及类似哥本哈根分级的方法,即观察组织学检查结果和DOTA-TOC PET成像,那将会好,进行PET检查时利用镓DOTA-TOC检测促生长激素2A型受体,以及利用FLT PET对偶发脑膜瘤进行分类方面大有可为。
这些年来,中国神经外科手术水平取得了较大的进步,同时也有很多国内青年神经外科医生有志于向国际神经外科教授交流,寻求技术精进突破。INC国际神经外科医生集团作为一个国际性的学术交流平台,自成立以来经常组织旗下国际神经外科顾问团的国际教授来华参加国内大型学术会议、举办专场沙龙,旨在与国内同仁共享神经外科领域的新技术成就,实现各国神经外科无国界的交流。
INC(International Neurosurgeon’s Circle)是一个专注于神经外科领域教授学术交流的医生集团。INC旗下国际神经外科顾问团(World Advisory Neurosurgical Group,WANG)成员均是来自国际各国神经外科不同细分领域的教科书级别专家。作为联接中外神经外科领域专家的纽带,集团近年组织国际神经外科教授专家来我国开展学术交流、技术探讨,并开展高难度手术;与国内多家医院展开合作,促进了国内外神经外科的共同发展进步,也为国内外神经外科患者提供了更多新的治疗选择。




