胶质瘤3~4级活多久?恶性神经胶质瘤是在外观和基因表达(异质性肿瘤)。III级神经胶质瘤的生存时间明显比IV级胶质母细胞瘤更长。即使在年级之内,生存时间也是高度可变的。相关阅读:胶质瘤能活多久?INC国际神经外科解析国际前沿治疗办法
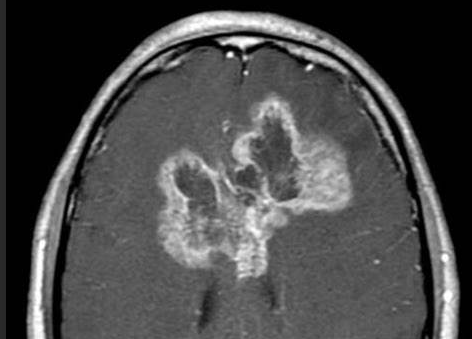
已研究了GBM(胶质母细胞瘤)的几种成像特性与生存的关系。许多研究小组已经报道,坏死和水肿的量的程度是负存活相关。一组报告了生存与大肿瘤囊肿的存在之间存在正相关关系。
临床数据也与生存率相关。较完善的是年龄和Karnofsky行为状态(KPS;)。生存与年龄成反比。例如,研究表明,GBM患者在18个月时的存活率对于40岁以下的人为50%,40-60岁的人为20%,60岁以上的人为10%。GBM患者的生存也与KPS负相关。与KPS得分为80或更高的患者相比,KPS <80的患者具有1.5的相对风险。一些研究得出的结论是更广泛的手术切除延长生存,而其他人没有发现的好处。
从常规影像学研究中更好地确定预后可能有助于做出治疗决策。例如,对有不良预后的患者进行更和实验性的治疗可能是合理的。由于大多数恶性神经胶质瘤患者均被诊断并接受了MR成像检查,因此在MR成像中生存与肿瘤外观之间的关系很重要。因此,我们分析了大量的影像学特征,以确定哪些影像学特征较适合作为预后指标。这些特征的选择易于从常规扫描中确定,因此可用于日常临床实践。
恶性神经胶质瘤是具有可变的生存时间。大多数恶性神经胶质瘤患者均被诊断出并接受了MR成像检查。因此,在MR成像中生存与肿瘤外观之间的关系很重要。我们分析了广泛的影像学特征,以确定哪种影像学作为预后指标较有用。这些特征的选择易于从常规扫描中确定,因此可用于日常临床实践。从常规影像学研究中更好地确定预后可能有助于做出治疗决策。
在对GBM患者的15个影像学特征进行单变量分析时,我们发现只有nCET,水肿和多灶性/卫星病变是统计学上重要的预后指标。水肿增加与患者预后较差之间的关系已得到明确证实。nCET的生存优势是一个新发现。对于GBM患者,中位生存期与中央电教馆为780天,465天无(相比P<.03)。水肿与nCET的存在呈负相关。年轻患者往往具有更高的nCET和更少的水肿,这可能反映了肿瘤生物学的根本差异,这可能部分解释了为什么年轻患者的中位生存时间比老年患者更长。尽管nCET在年轻患者中更为常见,但对于大于50岁的患者,其生存获益更为明显。有趣的是,GBM中遗传性病变的预后价值已显示出年龄依赖性。这增加了成像特征也可能表现出与年龄有关的效应的可能性。
通过组合有利与不利的成像功能,我们发现了生存曲线的较大差异。因此,GBM患者NCET和无水肿,卫星和多灶性有1098天的中位数存活(平均1106天; ? = 16)的患者相比无NCET但与水肿和任一卫星或多灶性(? = 17),中位生存期为437天(平均481天;P <.001)。总体而言,GBM患者的中位生存期为623天。这些数据说明了通过组合选定的影像学特征可以得出的深刻的预后重要性。
大的少突胶质细胞瘤成分与GBM患者的存活率提高相关。一些GBM尽管在病理上缺乏少突胶质细胞瘤成分,但仍表达少突胶质细胞基因。我们发现,大量少突胶质细胞瘤成分也与GBM患者的生存率呈正相关。因此,伴有少突胶质细胞瘤成分的GBM患者的平均生存期为1193天(SE,176天;n = 8),而平均生存期为703天(SE,60天;n = 102;P= .04)对于无或少有少突胶质细胞瘤组织学的GBM患者。数据分析还揭示了少突胶质细胞瘤成分与非增生性肿瘤之间的相关性。因此,nCET的部分生存益处可能是由于与少突胶质细胞瘤成分有关。在患有nCET但没有少突胶质细胞瘤成分的GBM患者中,有增加生存率的趋势,但这在统计学上并不显着。需要进行一项更大的研究,以显示在缺乏少突胶质细胞瘤成分的情况下nCET是有益的。
因为nCET区域没有坏死,所以它们可能对应于具有较低病理等级的肿瘤区域。胶质瘤的整体病理学分级基于病变的较侵袭性部分。然而,这些发现表明,肿瘤侵袭性较小的部位也显着影响预后。正在进行的遗传分析可能会提供有关有或没有少突胶质细胞瘤成分的肿瘤非增强部分之间相似性和差异的更多信息。
水肿是单变量和多变量分析预后,因为其他人报告。较少的水肿与nCET的存在之间存在关联。没有水肿的患者的中位生存期为1098天,而有水肿的患者的中位生存期为442天。在递归分区分析中,浮肿是一个分支点,nCET是二个分支点,这表明当一起分析时,这些是较重要的成像特征。仅在nCET存在时,水肿的存在才具有统计学意义。然而,只有少数无nCET的患者(n = 7)没有水肿,这可以解释为什么没有nCET的GBM患者的水肿没有统计学意义。
在GBM单变量分析中具有统计学意义的其他变量是多灶性和附属病变。伴有卫星病变或多灶性病变的患者生存率明显降低。尽管从直觉上讲这些发现是有道理的,但似乎没有先前的确证文献。多灶性神经胶质瘤与p53种系突变的发生率增加相关。因此,这些肿瘤可能代表具有不同遗传特征的GBM形式。确定多灶性和非多灶性胶质母细胞瘤中的基因表达将是令人感兴趣的,因为这些差异可能解释了多灶性疾病的预后明显较差。
几组报告说,坏死的程度和水肿的程度与生存率成反比。也有证据支持坏死的病理学证据与不良预后的关联。许多评估坏死的影像学研究发现,坏死的程度与存活率相关,而不仅仅是坏死的存在。在GBM中,存在与坏死相关的基因产物,这些产物与生存相关。我们发现几乎全部GBM都显示出坏死的迹象,但没有分析坏死的程度,因为确定坏死肿瘤体积所需的后处理对于常规成像不可行。然而,对于III级神经胶质瘤,我们确实发现坏死的影像学证据与预后差有关。
病理上,III级神经胶质瘤缺乏坏死。坏死的病理学证据与预后较差有关,通常可将III级和IV级肿瘤分开。尽管没有在组织病理学上发现坏死,但我们分析的大约25%的间变性神经胶质瘤具有坏死的影像学证据(即,中央T2加权信号强度较高,周围不规则增强)。差异的一部分可以通过采样误差来解释,在这种误差中,病理医生可用的肿瘤部分没有合并假定的坏死区域。例如,当后来被切除的标本显示GBM时,已经发现立体定向活检低估了被认为具有间变性星形细胞瘤的患者中很大比例的肿瘤。在我们的研究中,大多数坏死的III级肿瘤(8个中的5个)都进行了> 90%的切除,这应该减少采样误差。另一种可能性是坏死组织可能在手术时被抽吸,而无法用于组织病理学检查。我们发现,具有坏死影像学证据的三级神经胶质瘤的生存率可与GBM媲美,并且总体上比三级神经胶质瘤差。其他人也报告了类似的发现,其中显示环增强与坏死相容的间变性胶质瘤与不良的生存率相关。这增加了很大一部分诊断为III级神经胶质瘤的肿瘤(包括大部分已切除的肿瘤)为GBM的可能性。被诊断为三级神经胶质瘤的坏死性肿瘤患者的生存曲线支持这一结论。因此,III级神经胶质瘤和GBM之间的区别仍然具有挑战性。脑血容量研究显示,在区分低度恶性胶质瘤和恶性神经胶质瘤方面,敏感性有所提高(尽管特异性稍低)。然而,在没有的rCBV差异III级胶质瘤和GBM中发现。
除坏死外,我们还发现增强本身与更差的预后有关。但是,这可能是由于增强和坏死之间的密切关系所致。人们认为坏死会导致血脑屏障的损害,从而导致血肿增强和浮肿。III级神经胶质瘤患者仅表现出坚实的增强,因此缺乏坏死的影像学证据,其生存率与完全不增强肿瘤的患者相当。
据报道,少突胶质细胞瘤中特定的基因缺失与预后好转相关,与MR成像上不规则的非增强对比度边界有关。对于III级星形细胞瘤和混合性少星形细胞瘤,我们发现情况并非如此。实际上,III级肿瘤的边界不规则往往会缩短生存期,尽管这并未达到95%的置信度(P = .089)。有趣的是,不规则的对比增强余量似乎与存活率提高相关,但同样,仍未达到统计学显着性,这可能是因为边界平滑的病例较少(n= 4)。将需要更多的患者和更长的随访时间,以及与遗传数据的相关性,以确定肿瘤增强和非增强区域的遗传差异是否是存活的重要指标。已有报道,至少对于GBMs,肿瘤的对比增强区似乎比非对比增强区显示出更多的蛋白质组学模式。尚未对III级神经胶质瘤进行类似研究。
肿瘤切除术的存活益处仍有争议。在某些分析中,切除的程度是基于手术时外科医生的印象,而不是术后扫描。其他研究使用CT扫描而非MR成像,其他研究仅分析增强对比的肿瘤,而不分析增强和非增强肿瘤。一些研究还存在方法论缺陷。例如,在Stark等人的研究中,约有17%的GBM患者由于身体状况不佳而没有接受放射治疗。这引入了一个混杂因素,因为肿瘤较大的患者更可能会接受部分切除,而且病情也会较差,因此接受放射治疗的可能性较小。缺乏前瞻性研究可能是这场正在进行的辩论中的重要因素。
在我们的研究中,全部GBM患者均接受了放射治疗,每位患者均接受了术后MR成像,评估了肿瘤的增强和非增强。我们没有发现增加肿瘤切除术在统计学上具有显着的生存获益。一份有关大量患者的报告显示,只有切除了> 98%的肿瘤,生存率才能提高。我们研究的局限性之一是我们仅分析了常规MR成像扫描中显而易见的成像特征,而没有进行额外的后处理以获得初始和术后残余肿瘤体积。因此,我们无法证实这一发现。
GBM和III级神经胶质瘤的几种影像学特征是生存的有意义的评估指标。影像学特征的良好组合(包括nCET,无水肿,无卫星或多灶性病变)与不良组合相比,中位生存期增加了一倍,强调了这些标准在确定常规临床患者预后方面的潜在用途实践。随着更多治疗的出现,从影像分析中获得的信息可能会有助于指导更个性化的治疗方法。




