儿童丘脑
胶质瘤怎么治疗?尽管丘脑神经胶质瘤很少见,占儿童颅内肿瘤的1-5%,儿童丘脑胶质瘤的发病率相对于成人较高(1%)。儿童患者发病年龄中值为8-10岁,无性别偏好。儿童的症状持续时间各不相同,尽管6个月的平均值比成人长。然而,较短的症状持续时间可能预示着较差的预后,并且可能对应于较高的病理分级。
患有丘脑神经胶质瘤的儿童可能会出现一系列症状,这些症状归因于这些肿瘤的深部位置。较常见的症状包括颅内压升高、头痛、嗜睡、恶心、呕吐,如果不治疗,还会出现麻木和昏迷。多达50%的病例出现视觉症状。运动障碍很常见,而感觉障碍和运动障碍则不太常见。除了深部位置,肿瘤对丘脑周围结构的影响可能导致几种综合症状。例如,下丘脑受累导致内分泌疾病,而乳头丘脑束或穹窿受累可导致认知功能障碍和记忆问题。此外,双侧丘脑病变表现出特征性但不寻常的人格改变、记忆丧失、意识模糊、幻觉、摄食过度和精神发育迟缓。
丘脑胶质瘤可根据生长特征分为局灶性、弥漫性或双侧性。局灶性肿瘤发生在丘脑内分散的位置,并生长至超出解剖边界而扩展至周围白质和/或脑室(三脑室和侧脑室)。这些肿瘤通常相当于WHOI级青少年毛细胞星形细胞瘤,并可根据脑瘤界面或囊性或非囊性成分进一步细分。相比之下,弥漫型不显示界限分明的肿瘤界面,因此通常迁移到其解剖边界之外。这些肿瘤通常符合世卫组织II-IV级纤维型。
双侧丘脑胶质瘤值得单独讨论。这些肿瘤的发病率约为14%,被认为像多灶性神经胶质瘤一样起源于双侧,并在诊断时表现出双侧对称性。与其他报告一样,双侧丘脑胶质瘤患者的平均症状持续时间相对较短(单侧丘脑胶质瘤患者为2.5个月,而单侧丘脑胶质瘤患者为8.7个月)。令人惊讶的是,尽管这些病变的活检显示了较低的组织学分级,但预后更差;换句话说,尽管组织学级别较低,但这些肿瘤具有恶性病程。
影像学特征为丘脑胶质瘤的组织学和治疗方案提供了重要线索。前沿的神经影像提供了关于这些病变的代谢和生理的额外信息,因此有助于诊断和随访。与临床表现相似,这些肿瘤的影像学特征因恶性程度而异。高达20%的肿瘤是带有钙化的实性和囊性肿瘤。此外,尽管大多数恶性神经胶质瘤表现出瘤周水肿、强化和坏死,但这些特征在一些高级别肿瘤中可能不存在,这可能降低基于常规成像的肿瘤分类和分级的可靠性。前沿的MRI技术,如灌注MRI和MRS,可以提供额外的信息来支持肿瘤分类。在灌注MRI上,与高级别肿瘤相比,低级别的肿瘤具有相对低的局部脑血容量。在MRS上,高级别肿瘤如
胶质母细胞瘤表现出高胆碱峰,低N-乙酰天冬氨酸峰和高胆碱/肌酸比。此外,与坏死相关的脂质和乳酸盐水平升高有助于将胶质母细胞瘤与高级别胶质瘤(如间变性星形细胞瘤)区分开来。
管理
儿童丘脑胶质瘤的治疗方案尚未明确。考虑到术后发病率和死亡率的风险,临床医生以前倾向于采用包括立体定向活检和放疗的保守方法,而不是根治性切除术。然而,较近在影像学方法、神经导航系统、显微外科技术和术中电生理监测方面的改进已经为这些深层病变提供了清晰的解剖图像;因此,根治性切除这些肿瘤的一个选择子集与较低的发病率和死亡率相关。一般而言,与未接受手术的患者相比,接受丘
脑肿瘤全切除或次全切除的患者的预后和生存预后均有所好转。总生存率的提高与切除范围相关,并且可以以较低的发病率和死亡率实现。
边界清晰且不累及内囊后肢的增强离散病灶较适合于根治性切除。丘脑神经胶质瘤的各种手术方法已有描述,尽管内囊相对于肿瘤的位置是决定手术入路的关键因素。较佳方法通常取决于肿瘤在丘脑内的位置以及肿瘤与关键结构的范围和关系。Bilginer等人主张采用前纵裂经胼胝体入路切除上丘脑肿瘤,后纵裂经脾旁入路切除后丘脑肿瘤。厄泽克和蒂尔也对丘脑上部和前部肿瘤患者采用纵裂经胼胝体入路。相比之下,Baroncini等人对于上丘脑肿瘤,优选经皮质额入路。对于高功能区域或边界模糊区域的大肿瘤,Puget等人建议丘脑肿瘤分期切除。不能顺利切除的肿瘤应使用活检取样进行研究,以排除非肿瘤性病理实体,并根据组织学瘤种指导未来的辅助治疗。在可能只需要组织诊断或其他合适的情况下(如双侧丘脑肿瘤),应考虑立体定向或内窥镜活检。对于影像学诊断不明确的单侧病变,影像学或内窥镜引导下的活检可以确立诊断,并允许在开始开放手术前识别分子标记物。
对于恶性丘脑病变、多发性复发性肿瘤或残留疾病的患者,应保留放疗和化疗。然而,这两种选择都不优于完全切除,并且都具有潜在的长期不利影响,这是幼儿关注的问题。因此,在没有组织学诊断的情况下,不应考虑辅助治疗。对于不完全切除或进行性病变,大多数中心的总放射剂量为54戈瑞,分30次进行。然而,许多中心正在转向初级化疗,以避免晚期放射效应,如内分泌疾病、血管病变、视神经损伤和智力功能丧失。因此,如果可行的话,应该进行二次手术,以解决小的残留、复发或再生长的低级别胶质瘤。
目前,对于低级别神经胶质瘤的化学治疗没有标准化的方案。一般来说,这些病变用多种药物联合治疗,尽管研究报道了单种药物不同程度的成功。然而,长春新碱和卡铂的组合以及长春碱单一疗法已被接受为一线辅助化疗方案。相比之下,高级别神经胶质瘤的标准治疗包括手术和放疗。尽管已经测试了化疗药物的各种组合,但成人研究已导致大多数儿科神经肿瘤小组采用放疗与伴随和辅助替莫唑胺的组合作为治疗标准。
影响丘脑胶质瘤患者生存率的因素包括肿瘤分级、切除范围、辅助治疗和症状持续时间。尽管患有低级别神经胶质瘤的儿童具有相对较好的总体存活率,但丘脑部位预示着更差的结果,尽管在其他方面肿瘤生物学相似。对于高级别胶质瘤,根治性手术切除仍然是较重要的预后因素,除非预计会有严重的发病率,否则应予以考虑。鉴于其位置,双侧丘脑肿瘤被认为除了诊断性活检外不可手术,据报道,相对于单眼肿瘤,对放疗和化疗的反应较弱。因此,双侧丘脑肿瘤预后不佳。
James T. Rutka教授的丘脑胶质瘤治疗案例
案例1
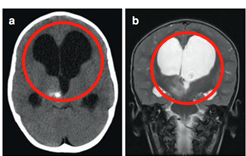
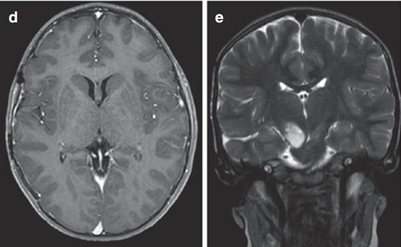
3岁患儿因呕吐和巨脑畸形就医。CT及MRI显示右侧丘脑病变伴钙化及后三脑室梗阻,引起脑积水(图1)。
图1
在8岁、11岁和13岁时,James T. Rutka教授成功地利用三脑室内窥镜切开术治疗脑积水(图2为系列影像),且影像显示肿瘤增大和多发肿瘤囊肿(箭头状),并逐渐出现左上肢震颤。
图2
患儿在13岁时进行了神经导航和超声引导下的活检,证实为脑瘤为WHO I级,毛细胞星形细胞瘤。
肿瘤囊肿持续扩大(图3),患儿发展为急性偏瘫。
图3
示同侧内囊(负责人体肢体运动)前外侧移位(箭头)(图4)。超声引导下将Ommaya导管和储层插入肿瘤囊肿。
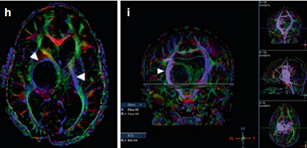
图4
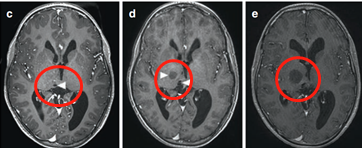
术后MRI显示囊肿和导管头端减压(箭头)。(图5j)四个月后,由于患儿的偏瘫没有好转,Rutka教授为其行经胼胝体半球间入路及肿瘤次全切除术。
术后影像(图5),术后患儿偏瘫好转,患儿生长和智力发育正常,近期随访显示脑瘤未复发。免疫组化检测RAF V600E突变免疫无阳性,H3K27M阴性。
图5
案例2
患者为一名9岁男童,左面部、上肢和下肢有3周的急性病史,持续轻微口齿不清三个月以上。他还有多处咖啡色的斑点和腋窝雀斑。被诊断患有注意缺陷多动障碍,这些症状可以归因于器质性病因。
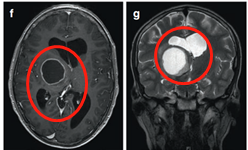
(图6a、b)轴位MRI造影剂及冠状面T2-WI显示一个环形增强的右侧丘脑结节肿瘤。
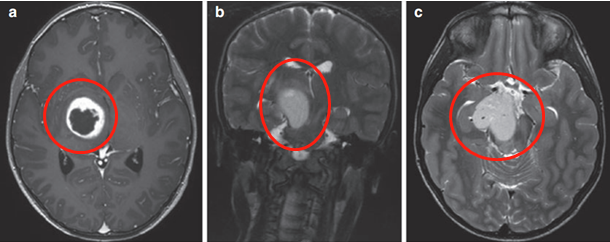
图6
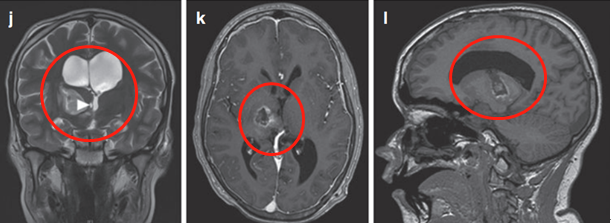
肿瘤累及内侧颞结构(图6c),Rutka教授考虑根据其病情进展制定综合治疗方案,先行经颞中回经脑室入路次全切除肿瘤,组织学为WHO I级毛细胞星形细胞瘤,BRAF重复融合状态为阴性。免疫组化检测BRAF V600E、H3K27M阴性。基因测试证实了NF1基因的变异。术后严密随访患儿术后情况。
(图7)六个月后的影像显示丘脑部分切除和中脑的小肿瘤残留,因此,Rutka教授根据其病情发展量身定制辅助治疗计划,患儿对放疗反应良好。
图7
丘脑胶质瘤的综合治疗
丘脑胶质瘤可以有多种病理类型,如星形细胞瘤、间变少突(星形)胶质细胞瘤、
胶质母细胞瘤等,少突胶质细胞瘤较少见,本组患者病理分级为WHOⅡ~Ⅳ级。众所周知病理类型对预后的影响是肯定的,Guillamo等报道成人高级别脑干胶质瘤预后差,高级别丘脑肿瘤与脑桥肿瘤有相似的预后。
手术作为丘脑肿瘤的一种治疗方式,其效果一直是有争议的。丘脑肿瘤位于大脑深部,虽然发生率不高,但由于丘脑肿瘤位于脑中线深部,毗邻内囊、下丘脑、三脑室等重要结构,手术难度大,手术病死率及病残率高,其治疗一直是神经外科的难题。Pathy等认为手术的患者较未手术的患者预后较好(中位生存时间12个月vs 5.82个月,P=0.0087),但其同样例数不多,有7例接受了手术治疗。从这些结论我们可以看到,手术应根据病变位置和病理分级做出更详细的选择,儿童低级别胶质瘤较多见,如毛细胞星形细胞瘤,而成人多为WHOⅢ~Ⅳ级,间变星形细胞瘤为主,无论从好转症状及延长生存期来说,可能低级别胶质瘤更能收到较大的获益。Sai Kiran等研究同样支持这一观点。
放疗作为丘脑胶质瘤的重要治疗手段,其选用的放疗剂量和照射方式是我们应该关心的问题,但报道较少,Pathy等将放疗剂量分为小于50Gy组和大于50Gy组,中位生存期分别为4个月和11个月(P=0.051)。2012年美国NCCN发布的中枢神经系统肿瘤治疗指南显示,烷化剂替莫唑胺的临床应用可性好转高级别胶质瘤患者的无进展生存期和总生存期,Stupp等总结了573例脑胶质瘤患者,分为替莫唑胺同步放化+放疗后化疗组和单纯放疗组,结果显示放化疗组好于单纯放疗组,中位生存期分别为14.6个月和12.1个月,5年生存率分别为10%和2%(P<0.001)。Minniti等得出同样的结论。
总之,病理WHO分级和放疗期间同步化疗是影响丘脑胶质瘤患者预后的主要因素,更高的放疗剂量以及手术并未显示出有价值的结果,这提示我们应更加注重细化患者的类型,明确病理分级,区别对待每一位肿瘤患者,以期达到较大的治疗收益。
后记
在过去的几十年里,神经影像、麻醉药、显微外科技术、术中神经导航和神经生理监测的进步使得外科手术顺利切除这些病变,特别是边缘离散的低度病变。多学科治疗还包括放射治疗和化疗,但丘脑胶质瘤的治疗标准尚不明确。治疗应根据患者的年龄、临床状况和瘤种进行个体化。总的来说,丘脑胶质瘤患儿预后良好。
James T. Rutka教授供职的加拿大多伦多儿童医院(SickKids)是加拿大的集治疗、科研和教学为一体的儿童医院之一,病童医院在北美前三,并且是国际范围内较早一批引入激光间质热疗(litt)技术的儿童医院。Rutka教授还在此一手创办了亚瑟和索尼亚拉巴特脑瘤研究中心,其实验室在研究脑肿瘤生长和侵袭的机制方面颇有成就,并且正在设计一种基于纳米颗粒的输送系统,使其作为胶质瘤的一种新疗法造福更多脑瘤患者。