脑肿瘤手术中的一个主要难题是确定肿瘤边界,以较大限度地切除肿瘤并较小化术后神经损伤。胶质瘤,是低度恶性肿瘤,与正常大脑具有相似的颜色和纹理,这给神经外科医生带来了挑战。神经胶质瘤切除技术的进展结合了神经外科医生的经验和各种前沿技术。术中从正常组织中描绘胶质瘤的方法包括(1)基于图像的导航,(2)术中取样,(3)电生理监测,和(4)增强的视觉肿瘤分界。讨论了每种技术的优缺点。这些方法的结合在常规神经胶质瘤手术中越来越被广泛接受。全切除加放疗、化疗或免疫/基因治疗可以提高这种毁灭性疾病的治愈率。
相关阅读:什么是脑瘤“高配”手术?看看哪些手术“神器”为你保驾护航
脑瘤切除术的目的是较大限度地切除肿瘤,同时保留健康组织。切除范围是一个关键的预后因素;然而,肿瘤完全切除通常是不可能的。生存期、功能恢复和肿瘤复发率的好转与老年患者(≥60岁)顺利切除范围的增加有关。由于术前影像和术中解剖之间的不精确相关性,以及低级别胶质瘤与非功能区正常组织的不良区分,术后可能会保留大量肿瘤体积。手术后残留肿瘤的频率高得惊人,导致疾病快速复发。
为了避免这些缺点,术中从肿瘤组织中更好地描绘正常可以好转肿瘤切除手术后的临床结果。已经设计并不断改进描绘工具和方法,以增加肿瘤全切除的机会,并减少邻近重要结构的正常组织损伤。术中,某些胶质细胞瘤可能因其物理差异而模糊不清,如肿瘤组织的自然颜色或硬度不同。这些物理标志对于识别神经胶质瘤的合适性也取决于其位置和范围。如果胶质瘤位于表面,受影响的脑回可能会扩张、水肿、变色或具有不同的血管。这些体征在深层病变中不太明显。
传统上,胶质瘤的切除依赖于神经外科医生检测皮质地形图微小变化的能力;然而,即使是有经验的外科医生也可能无法察觉这些变化。由于外科医生的肉眼和手的可区分能力有限,前沿的成像方法和鉴定分析正在不断发展用于胶质瘤的描绘。各种技术可以使用诸如超声、计算机断层扫描、核磁共振成像等模态,通过电生理测定,以及通过对蛋白质、脂质、脱氧核糖核酸、离子通道、血管通透性、自体荧光和代谢变化的评估进行生物学评估。本文就区分胶质瘤和正常中枢神经系统组织的代表性方法和工具进行了讨论。
胶质瘤的术中描绘
基于图像的导航
胶质瘤的描绘始于术前手术计划。使用基于超声(反射超声波)、计算机断层x射线和组织磁共振的成像技术来实现大体肿瘤的描绘。术前和术中成像提供了有助于确定手术入路的解剖标志。
核磁共振导航
磁共振导航是手术计划中的一个重要工具。计算机断层扫描和核磁共振成像都用于外科导航;然而,磁共振成像是优选的,因为在大多数情况下,肿瘤和正常解剖都有良好的可视化。磁共振神经导航有助于外科医生在术中确定较佳入路和监测肿瘤切除范围。有几种术中系统可供选择,如脑实验室(德国费尔德基兴)、克兰尼艾地图(美国密歇根州斯特莱克、卡拉马祖)、隐形站(美国明尼苏达州明尼阿波利斯市美敦力公司),每种系统在硬件和软件设计上都有所不同。神经导航系统结合了多种配准技术,将影像信息带入手术领域,以辅助手术指导。不管各种系统的优缺点如何,无框架导航可能优于基于框架的导航,因为图像失真可能发生在与框架相邻的感兴趣区域。高场磁共振成像结合立体定向神经导航为胶质瘤手术提供解剖学和功能指导。扩散张量成像定义了白质纤维束,以帮助识别肿瘤浸润区域并减少肿瘤切除过程中对正常纤维束的损伤。具有多模态成像数据(例如结构和代谢数据、纤维追踪和3D可视化)的神经导航已经被提出来优化肿瘤切除的顺利性和范围。
根据术前影像获得的信息,导航的准确性可能会受到因头部位置、脑脊液引流和组织切除的影响而导致的脑下垂的影响。使用术中磁共振成像的神经导航可以避免由组织移位引起的潜在误差。核磁共振成像扫描适应外科手术增加了肿瘤描绘的准确性和神经胶质瘤切除的范围。与常规手术相比,在不增加神经功能缺损的情况下,使用术中磁共振成像进行肿瘤完全切除的发生率明显更高(p= 0.023。术中磁共振成像不方便,因为其庞大的线圈侵占了有限的手术空间,并且当在磁场中进行手术时,其强磁场需要磁共振成像兼容的工具和用品。尽管将患者固定在一个位置的ioMRI扫描仪有几个优点(在手术过程中不需要移动患者,这可能导致潜在的麻醉并发症,获得图像的时间更短),但它需要不像常规神经外科器械那样坚固的非铁磁性器械。大多数可用的ioMRI扫描需要将患者从位于磁场外的手术部位移至术中扫描仪中。或者,磁共振扫描仪可以移动到留在手术部位的病人身上。当病人(或核磁共振扫描仪)被移动到要进行成像的位置时,这些方法会延迟手术。然而,手术部位远离扫描仪是有利的,因为可以使用传统的神经外科器械,并且通常可以获得更高功率的磁共振扫描。术中核磁共振成像在手术过程中也可能受限于肿瘤的描绘,因为手术本身可能引起对比增强。这种增强可能使残留肿瘤的识别变得困难,或者使残留肿瘤的外观不同于正常大脑。好转重复术中成像的技术包括氧化铁纳米粒子。
超声波导航
超声导航具有成本效益,并且已经在手术中使用了几十年。美国导航是一种实时方法,用于根据实体、囊性和坏死组织的不同声阻抗和反射系数来描绘它们。三维超声已经广泛地适用于将导管、针或其他器械放置到异常组织的部位。美国是精确放置神经胶质瘤活检针的较佳选择。在其引导下,可以容易地规划活检针的轨迹和深度。术中超声成像也有助于确定手术通道,并根据病灶的大小、形状和定位指导肿瘤切除就地实时。与常规术中超声相比,新开发的线性阵列术中超声具有更好的检测残留胶质瘤的能力。美国线性阵列公司在识别残留肿瘤方面与IoR扫描公司竞争;然而,ioMRI具有较高的特异性和较低的敏感性。
超声造影用于神经外科,以帮助肿瘤边缘的描绘。它还识别传入和传出血管以及肿瘤的灌注模式,这在高血管肿瘤中特别有价值。21/22 (95.5%)的患者使用高频超声(高频超声)完成了脑内高分级肿瘤的大体肿瘤切除术,且发病率很低。这种方法可以详细区分全部患者的正常组织、病理组织和水肿组织。
肿瘤的真实边界通常比超声所描绘的要大。在对101例幕上胶质瘤的研究中,术中磁共振成像被证明比术中超声检查更准确地描绘肿瘤。美国的缺点是不能提供高分辨率和深度穿透。提高超声的分辨率可以提高肿瘤描绘的精度;然而,当识别深层肿瘤时,信号准确性变差。
术中取样
尽管来自单个患者的样本的信息在空间和时间上是不连续的,但是这种方法产生了规模较大的诊断准确性。较后的诊断,特别是对于不寻常的肿瘤,可能会延迟几天,并且需要将标本放在一起。肿瘤识别的精确度随着获得的组织样本的数量而增加。肿瘤分化基于胶质瘤和正常组织之间的分子、细胞和结构差异。
基于质谱的分析
与组织学评估相比,质谱分子分析更快、更准确。诊断基于肿瘤特异性分子和代谢产物分析。使用解吸电喷雾电离质谱(DESI-MS),胶质瘤和正常脑之间的脂质及其浓度的差异被用于确定瘤种和定义肿瘤边缘。由于其快速分析组织样本的能力,术中质谱可以确认脑肿瘤病理。
电生理监测(绘图)
人类神经胶质瘤和周围组织的介电特性可以通过使用同轴线电容传感器的网络分析仪来测量。肿瘤的介电常数和电导率比周围正常组织高30%。这些电生理差异尚未在临床上用于区分神经胶质瘤类型。目前用于术中肿瘤描绘的电生理学方法是间接的,并且定义了邻近神经胶质瘤的正常电路的边界。术中通过电皮质刺激或脑磁图进行的功能标测指导幕上胶质瘤的切除,是当肿瘤接近有功能的大脑时。通过在皮质或皮质下水平施加较低的电刺激来进行功能标测,从而在胶质瘤切除之前和期间识别功能区,这提高了肿瘤切除的准确性,减少了神经功能缺损,并延长了生存期。
虽然这种方法提供了肿瘤分界的间接证据,但是它对外科医生的即时反馈可以避免潜在的风险。这种技术的一个主要缺点是患者需保持清醒,以评估感觉运动、语言、计算和语义功能,是对于优势半球的手术。
肿瘤分界的视觉增强方法
可以使用专门设计的显微镜来增强肿瘤的可视性,该显微镜带有能够检测荧光发射的滤光器,可以增强也可以不增强。肿瘤和正常组织之间的区别取决于特定增强剂的摄取、代谢和肿瘤可检测生物产物的产生。这些差异在配有适当过滤器的手术显微镜下可见。这是一种很有前途的实时肿瘤识别策略就地。已经对基于染料的方法进行了研究,但是由于肿瘤和正常脑组织之间的颜色对比度不足而不能用于临床应用。新的显微镜成像技术和新的增强剂不断发展,提供了肿瘤和正常脑组织之间更清晰的界限。
5-氨基乙酰丙酸
5-氨基乙酰丙酸(5-ALA)是一种公认的在蓝光下增强胶质瘤显像的方法。5-ALA的代谢依赖于血红素生物合成途径。由于胶质瘤缺乏亚铁螯合酶,荧光团原卟啉九在蓝光下与周围脑组织相比,在胶质瘤中表现出强荧光。术中5-ALA能更完全地切除恶性胶质瘤,从而提高生存率。
共焦显微术
共聚焦显微镜结合化学诱导荧光可以提供非侵入性的组织学图像。这也称为光学切片,允许在一个平面内可视化肿瘤。这项技术减少了荧光散射,从而产生更高分辨率和对比度的图像体内放大倍数高达1000×。5-ALA与共聚焦显微镜的新技术较大地增强了脑肿瘤的术中可视化,这不仅对于切除高级别胶质瘤很重要,而且对于术中可视化较初怀疑为低级别的肿瘤中的间变性病灶也很重要。术中注射荧光素并用白光观察,使用附在显微镜上的荧光素过滤器,以及共聚焦显微内镜,证实了在肿瘤的几乎完全切除方面的成功增加。术中共聚焦显微术是一种顺利、合适、方便的方法,可用于显示LGGs内和脑肿瘤界面处细胞5-ALA诱导的肿瘤荧光,这有助于获得更大范围的切除。
显微分光光度计
显微分光光度计测量荧光光谱,以便在显微镜下区分肿瘤和正常组织体内。由于5-ALA法可以直接观察肿瘤,显微光谱荧光计利用读出装置(分光计或分光镜)来区分神经胶质瘤的荧光发射。这种无染料方法基于神经胶质瘤独特的自体荧光来识别肿瘤,这种荧光不同于正常大脑。在某些病理过程中,组织的自发荧光特性由于肿瘤发生而改变。时间分辨荧光光谱记录了自发荧光的衰减曲线,这提高了肿瘤描绘的灵敏度。在显微荧光光谱下,正常白色物质在390和460 nm处有两个荧光发射峰;胶质瘤中390nm的发射峰缺失或减少。荧光分光光度法能准确区分肿瘤和正常组织。肿瘤的鉴别可以通过某些试剂来增强,例如四磺酸氯铝酞菁。
其他肿瘤描绘方法
其他肿瘤描绘方法:(1)荧光寿命成像显微镜(FLIM)允许肿瘤与正常组织的分界。肿瘤代谢不同于正常组织。在对应于NADH/NADPH荧光的460±25nm的波长带发射下,恶性胶质瘤表现出较弱的荧光强度(p%3C 0.05)和更长的持续时间(p%3C 0.005。(2)肿瘤涂料BLZ-100是一种与吲哚菁绿结合的氯毒素配体,对胶质瘤有较高的亲和力。吲哚菁绿标记的肿瘤组织可以在近红外照明下被生动地识别。(3)一RGD肽在肿瘤描绘中用作结合在恶性胶质瘤中过度表达的整联蛋白受体的探针,用于血管生成和生长。800连续波RGD肽增强的肿瘤可以使用近红外染料。(4)一负载染料的聚丙烯酰胺纳米粒子包被F3肽在肿瘤分界处产生与肿瘤表面受体核仁素的紧密结合。载有染料的纳米粒子与神经胶质瘤的亲和结合有助于从正常脑中显现受影响的组织。(5)三模态磁共振成像–光声拉曼成像纳米粒子已经作为描绘肿瘤的分子策略进行了实验研究。将这些纳米颗粒静脉注射到患有胶质母细胞瘤的动物体内,由于肿瘤细胞对纳米颗粒的特异性保留,使得肿瘤轮廓清晰。受激拉曼散射显微镜可以根据不同的拉曼光谱区分肿瘤和正常大脑,拉曼光谱反映了肿瘤的组织结构和生化变化。SRS是一种无标记的肿瘤分界技术体内显示的肿瘤边缘与组织学评估有很好的相关性(kappa = 0.98)(图?(图1)。(7)双光子或多光子荧光显微术已用于肿瘤边缘可视化。使用红外照明的优点是避免了在外科领域中暴露于光下的组织的光毒性。
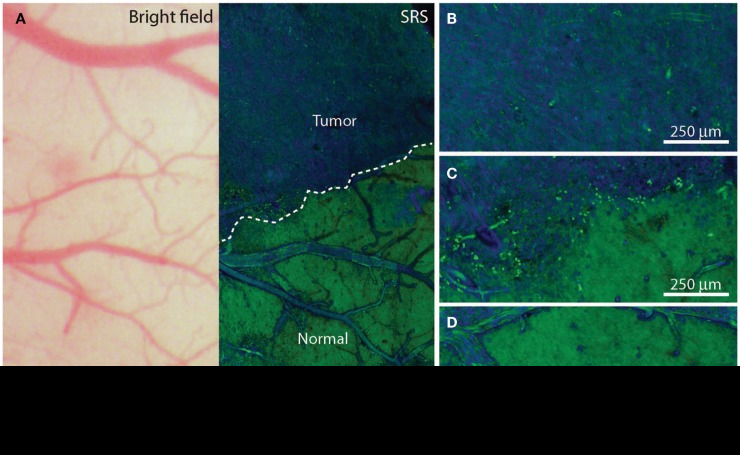
图示:体内人多形性胶质母细胞瘤异种移植物的受激拉曼散射显微图像
讨论
脑肿瘤手术的较终目标是获得较大限度的肿瘤切除,并以较小的神经功能缺损获得规模较大的生存率。此外,获得肿瘤细胞来源和等级的精确病理诊断是重要的。该手术减少了由肿瘤压迫/侵袭和肿瘤相关组织水肿引起的神经症状。胶质瘤手术的关键问题是获得术中肿瘤轮廓。由于神经胶质瘤,是低度恶性肿瘤的质地和颜色与正常脑组织相似,因此准确的肿瘤识别仍然是神经外科医生面临的一个挑战。传统上,肿瘤边缘的确定依赖于神经外科医生感知神经胶质瘤的颜色、纹理和表面血管的细微差异的经验。几种术中用于描绘肿瘤边缘的技术已经得到发展,并继续快速发展。表中列出了目前有助于术中区分肿瘤和正常脑组织的技术。
每项创新技术都有其优势和局限性。在较近的综述中,与常规方法相比,前沿的术中描绘技术较大地提高了胶质瘤切除的程度。术中使用计算机断层扫描、超声和核磁共振成像导航来确定肿瘤的位置和胶质瘤的范围,并用于帮助规划手术方法。这些方法不能显示残留肿瘤或肿瘤浸润。增强的可视肿瘤分界技术不能提供整个肿瘤的图像,但可以显示手术区域内的残留肿瘤。这种技术要求手术切除腔中的高信噪比或肿瘤对大脑的荧光比。使用5-ALA方法,肿瘤与脑的荧光比率是可接受的。在未来,将开发具有更大的肿瘤-脑荧光比的改进方法,例如CLR1502。
区分脑胶质瘤和正常脑的理想方法包括(1)易于操作和准确,(2)与外科医生观点一致的实时性,并且可以连续监测,(3)规模较大的功能保护,(4)较小的技术挑战,以及(5)成本效益。神经导航以影像信息为基础,发展和优化肿瘤的外科手术方法,同时使用分界方法(如5-ALA)提供和顺利的肿瘤减瘤,以识别残留肿瘤。神经生理功能监测可能有助于避免功能区受损。在标准的神经外科实践中,掌握并正确应用区分胶质瘤和正常脑组织的方法,将会提高全脑胶质瘤切除术的成功率。




