INC国际神经外科医生集团旗下组织世界神经外科顾问团(WANG)成员Mitchel S.Berger教授等发表研究《Interventional neurorehabilitation for glioma patients:A systematic review胶质瘤患者介入性神经康复治疗:系统性综述》,以下是研究简述。


胶质瘤手术的核心目标是在最大化肿瘤切除范围的同时,最小化影响患者生活质量的术后神经功能缺损风险。实现这种精细平衡始终是神经外科面临的挑战,也是患者及家属关注的核心问题。当生存期与生活质量需要权衡时,不可治愈的恶性肿瘤患者(特别是高龄及身体状况衰退者)往往更倾向于保障生存质量而非单纯延长生存时间。
多项研究探讨了胶质瘤患者手术并发症与生存期的关联。一项228例IDH野生型胶质母细胞瘤病例系列研究显示,新发术后神经功能缺损是总生存期的独立预测因素。术后未出现新缺损患者中位生存期达28.4个月,而出现至少一项新缺损者仅为11.6个月。Rahman等的胶质母细胞瘤研究进一步证实,即使达到95%切除范围,其生存获益也会被新发术后缺损所抵消。保持或改善神经功能状态的重要性不仅限于生活质量的层面,更直接关系到患者的总体生存。
神经调控技术的作用机制
介入性神经康复技术通过侵入性与非侵入性神经调控方法,利用人脑神经可塑性促进功能恢复。重复经颅磁刺激通过电磁线圈调节神经回路活动,根据方案参数可对脑网络产生长效抑制或兴奋效应,分别类比长时程抑制与长时程增强现象。例如在慢性神经病理性疼痛治疗中,高频rTMS(5/10/20Hz)可产生镇痛效应,而低频刺激无效。
目前虽无高低频rTMS的标准化定义,但≤1Hz通常视为抑制性,10-20Hz为兴奋性。θ脉冲刺激作为rTMS变体,采用每200ms发放低频脉冲串的模式。虽然θ-γ耦合在胶质瘤环路的适用性尚未证实,但间歇性θ脉冲刺激呈兴奋性,连续性θ脉冲刺激呈抑制性。rTMS在多种神经精神疾病治疗中已取得积极成果,根据TMS治疗指南,病灶侧M1区高频rTMS对卒中后运动功能恢复具有A级证据,在失语症治疗、上肢功能康复及卒中后痉挛改善中也显现优势。
其他神经调控技术进展
经颅直流电刺激作为非侵入性技术,通过头皮电极施加微弱电流。传统tDCS设置包含靶点电极与参考电极,电流方向区分阳极刺激(膜去极化,兴奋性)与阴极刺激(抑制性)。其作用机制涉及静息膜电位调节、皮层兴奋性改变、神经元放电频率及振荡模式调整等。随机对照试验显示,左侧Wernicke区tDCS可提升健康受试者及慢性卒中后失语症患者的图片命名准确率并缩短反应时。对69项研究的Meta分析证实tDCS对工作记忆、抑制控制、认知灵活性及心理理论等认知功能具有显著改善作用。
侵入性神经调控的探索
尽管神经外科文献中侵入性神经调控报道较少,但其可实现更精确的皮层靶向定位。一项5例胶质瘤研究在残留肿瘤区植入轮廓化硬膜下网格电极,术后进行皮层外电刺激定位。确认功能区位点后,采用连续皮层电刺激诱发轻微行为障碍,并通过每日调整参数促进脑网络重组,直至功能缺损消失。
治疗前景与挑战
近期系统综述指出多种药物与非药物疗法对脑肿瘤患者功能缺损具有改善潜力,但多数研究存在方法学局限。面对近三十年物理与认知治疗进展缓慢的现状,神经调控介入性康复有望成为神经肿瘤治疗体系的新工具。
研究目的
利用人脑神经可塑性潜力已被日益视为神经肿瘤学的重要范式,旨在实现脑肿瘤安全切除的同时,保留神经功能并提升生活质量。介入性神经康复治疗通过侵入性与非侵入性神经调控技术,成为诱导或增强神经可塑性、促进脑肿瘤患者功能恢复的新兴治疗策略。本研究旨在系统综述针对胶质瘤患者的介入性神经康复技术。
研究方法
遵循PRISMA指南,检索自建库至2023年11月28日期间Medline、Embase、Web of Science、APA PsycINFO及Cochrane数据库。纳入标准为涉及胶质瘤患者神经调控技术应用的研究报告。
研究结果
系统检索获得4770篇文献,去重后筛选3190篇,共7项研究(涉及118例患者)符合纳入标准。识别出三类神经调控技术:经颅磁刺激(TMS,占71.4%)、经颅直流电刺激(tDCS)及网格电极连续皮层电刺激(cCES)。所有应用非侵入性刺激改善术后功能缺损的研究均显示至少一项结局指标改善。应用tDCS与cCES诱导可塑性的2项研究均报告了功能重组证据。
本研究首次系统分析神经调控作为神经肿瘤康复新范式的证据。为成功设计神经调控临床试验,需加强基础研究明确癌症如何影响神经元结构与功能。根据刺激靶点与肿瘤位置关系,现有方案可分为三类:A.瘤内/瘤周;B.同侧半球远隔区;C.对侧半球远隔区(图1)。Krishna团队最新研究表明胶质母细胞瘤通过功能重塑脑回路促进进展,瘤内高连接性患者生存期(71周)显著低于无连接性患者(123周)。
未来试验需探讨神经调控抑制瘤内连接性能否带来生存获益。治疗时机是另一关键因素。Hordacre等对60例卒中患者的研究发现,卒中后2周对侧半球皮层兴奋性抑制最显著,而同侧半球cTBS反应无时间依赖性。卒中后关键期研究(CPASS)Ⅱ期临床试验指出运动恢复黄金期为卒中后60-90天。虽然现有证据源于卒中研究,但未来脑肿瘤神经调控研究需明确最佳干预时间窗。
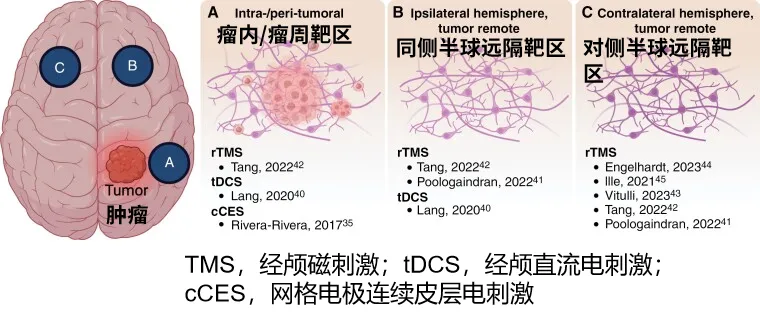
神经调控靶点与神经环路重塑机制,现有研究中,神经调控技术的应用靶区呈现三类分布模式:
A类(瘤内/瘤周靶区):3项研究针对肿瘤内部及周边区域实施调控;
B类(同侧半球远隔靶区):3项研究选择肿瘤同侧半球但远离病灶的功能区;
C类(对侧半球远隔靶区):5项研究将调控靶点定位於肿瘤对侧半球功能区。
结论
本系统综述表明神经调控作为胶质瘤术后功能缺损患者的神经康复策略具有潜力。现有文献显示TMS/tDCS安全性良好,可能是促进功能恢复的有效工具。未来需开展大规模试验以实现:①结局指标的定量整合;②阐明这些技术在其他网络可塑性诱导中的作用。




