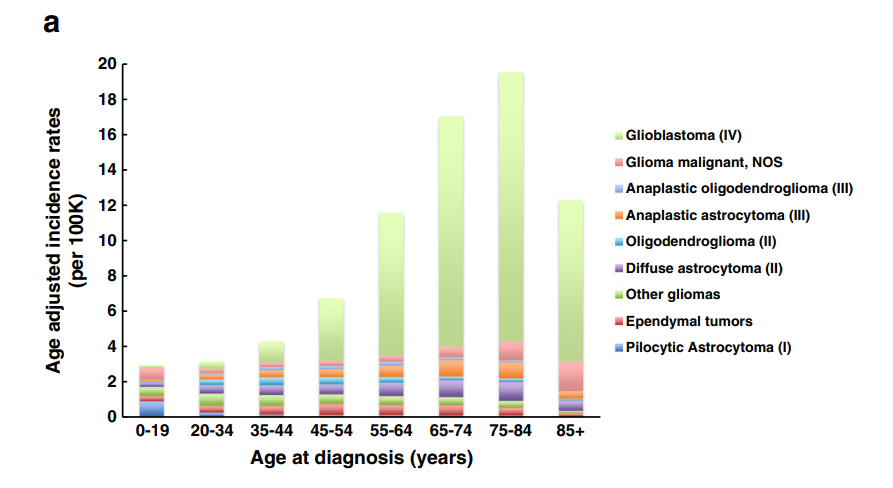
脑胶质瘤是影响大脑和脊髓的中枢神经系统肿瘤。正常的胶质细胞(星形胶质细胞、少突胶质细胞和室管膜细胞)支持神经功能,有助于血脑屏障,髓鞘轴突,并作为脑脊液-脑屏障的一部分排列在脑室。胶质瘤细胞的起源尚不完全清楚,可能包括原始神经干细胞、胶质祖细胞或成熟细胞类型的分化。这些祖细胞也可产生混合系肿瘤,如脑胶质瘤。原发性中枢神经系统肿瘤在成年人(每10万人中有29人)比儿童和青少年(每10万人中有6人)更常见,是儿童中常见的实体瘤种。脑胶质瘤仅占全部原发性中枢神经系统肿瘤的27%,但重要的是,它们占全部原发性恶性中枢神经系统肿瘤的80%。75%的胶质瘤是星形细胞瘤,常见的是高级的亚型,胶质母细胞瘤(图a),其特点是其5%的5年生存率很低。
在过去的十年里,胶质瘤的分类模式发生了较大的变化,这是由于分子分析技术的进步。国际卫生组织2016年版(以下简称世卫组织2016年版)关于胶质瘤的章节已经重组,纳入了结合组织学和分子遗传信息,提高了预后的准确性。
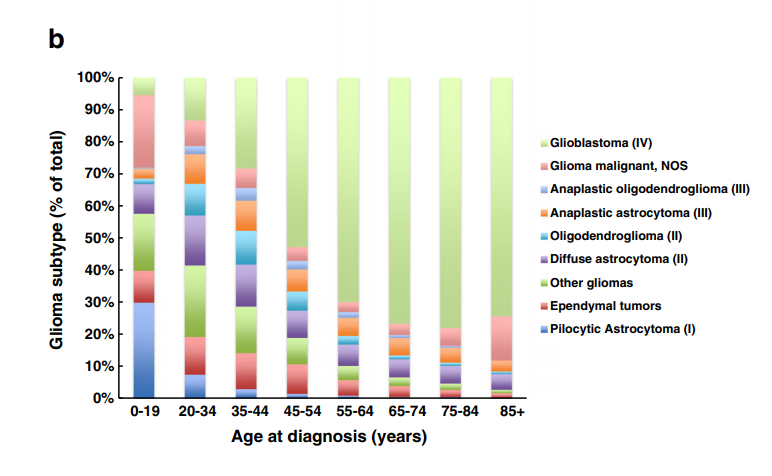
弥漫性胶质瘤转移是全脑中常见的成人脑瘤,但弥漫性胶质瘤是常见的原发性恶性肿瘤。在儿童和青少年中,常见的胶质瘤是放射学上界限清楚的低级别毛细胞星形细胞瘤,但也会出现高级别弥漫性胶质瘤(图b)。临床上具有损害性,中位生存期约为1年。
弥漫性胶质瘤的亚型包括星形细胞瘤:弥漫性星形细胞瘤、间变性星形细胞瘤和胶质母细胞瘤(分别为WHO2级、3级和4级)、少突胶质细胞瘤(包括间变性病例)、少星形细胞瘤(在分子时代异常少见),以及WHO 2016年新增的弥漫性中线胶质瘤,H3 k27m突变体。弥漫性胶质瘤在肉眼和放射学上界限不清,经常浸润到明显边缘以外。组织学上,肿瘤细胞与正常细胞如神经元和原生胶质细胞混合,当它们聚集在神经元(卫星状)、血管和软脑膜周围时,形成二级细胞结构。
免疫组织化学(IHC)是区分弥漫性胶质瘤和他们的模拟,包括反应性星形细胞增多。包含IHC胶质原纤维酸性蛋白(GFAP)可以帮助区分肿瘤神经胶质细胞的反应性星形胶质细胞分布更均匀,而包含IHC少突细胞转录因子2 (OLIG2)和SRY-box 10 (SOX10)可用于突出显示肿瘤细胞核,鉴于本地少突胶质细胞通常是的非肿瘤的细胞染色。神经丝(NF)的免疫组化将突出夹闭的轴突,证实浸润性生长模式的存在。微管相关蛋白2 (MAP2)的免疫组化也可以用于区分反应性星形细胞过程(MAP2阴性)和弥漫性胶质瘤(MAP2阳性)。其他的鉴别诊断注意事项将在中深入讨论。根据传统的形态学分类,低级星形细胞瘤,弥漫性星形细胞瘤(WHO 2级),以轻度的细胞增生和核异型性为特征,没有高级星形细胞瘤的附加特征。核变大,形状不规则,或伸长和深染。不幸的是,到目前为止,还没有明确的有丝分裂切断,因此,WHO 2级和3级星形细胞瘤的划分可能需要重新检查或通过尚未确定的分子谱来确定。胶质母细胞瘤(WHO 4级)还伴有微血管(原来是内皮细胞)增殖或坏死,后者常伴有肿瘤周围细胞核的栅栏化(。因此,星形细胞瘤分级的组织学标准通常被概括为记忆体BAMEN,即异型性、核分裂、内皮(微血管)增殖和坏死。
少突胶质细胞瘤(WHO级2)由细胞核小到中等大小、圆形、均匀、染色质粗和胞浆稀少的细胞组成。福尔马林固定产生一种人工的核周围清除,称为“煎蛋”的外观。少突胶质细胞瘤的其他特征包括突出的分支状毛细血管网,呈鸡丝状,有钙化和小细胞(比星形细胞瘤小)。间变性少突胶质细胞瘤(WHO 3级)的特征是经常有核分裂、细胞增多、核多形性、微血管增生和坏死。少突神经胶质瘤没有WHO 4级分类。
参考文献:Doi:10.1007 / s00428-017-2181-4




