
“我们拥有国际上较大的脊索瘤患者群,对于脊索瘤,有很多关于发病机制的研究和了解方面的进展。在过去的10-15年里,我们的主要发现是,没有单一类型的脊索瘤,全部的脊索瘤在特定的患者中的表现都是不同的。我们现在在法国有多种生物标记物来识别我们将来要面对的脊索瘤,并且已经开始应用,根据特定患者调整治疗方案的性。我们需要找到治疗复发脊索瘤的方法,脊索瘤对化疗反应不佳,所以需找到治疗她的新靶点、新方法,这样可以使脊索瘤通过手术和放疗治愈,然而直到现在我们没有太多选择。但是有很多研究正在进行,我们正在这个领域做一些研究,试图为这些患者找到一些新的治疗方法。”

——INC法国福洛里希教授
脊索瘤是一种少见的低度肿瘤(低度肿瘤是指肿瘤细胞分化程度较高,异型性较小,恶性程度相对较低的一种肿瘤。)源自脊索胚胎残留物,这解释了它们为何较常见发现于中线位置。脊索瘤通常是偶发的;然而,已经出现了少见的家族性脊索瘤病例。事实上,编码brachyury(一种用作脊索瘤诊断标记的转录因子)的TBXT基因重复已被描述为家族性脊索瘤的易感性机制。此外,TBXT中常见的等位基因变异(rs2305089)与家族性和散发性脊索瘤的风险增加相关。
尽管手术和放射治疗(RT)技术取得了进步,但这些肿瘤的长期预后仍然很差,5年和10年无进展生存率(PFS)估计分别为65%和32%。然而,脊索瘤患者的临床结果各不相同,疾病进展可能由术前放射学特征、临床特征、手术结果和少数生物标志物决定。
如今,还没有经过验证的分子预后或治疗脊索瘤的生物标志物。考虑到手术和辅助放疗的潜在并发症率,评估和指导临床决策的能力是脊索瘤的重要因素。考虑到二代基因测序(NGS),目前对脊索瘤分子生物标志物与脊索瘤预后不良的关联因素的研究有限,例如纯合CDKN2A缺失、染色体22q缺失、PBRM1突变和SMARCB1丢失。
脊索瘤复发率高,并且迄今为止任何批准的药物治疗都没有很好的益处。对于手术和放疗无法控制的复发性脊索瘤,迫切需要系统治疗。脊索瘤基因分子改变的研究对于评估、指导临床决策和识别治疗诊断生物标志物至关重要。
因此,基因测序的广泛应用促进了治疗诊断生物标志物的发现识别和新疗法的开发。然而,很少有大型研究描述了脊索瘤的全基因组学描述,而目前不少相关研究要么受到使用全外显子组测序(WES)分析的肿瘤数量较少或脊索瘤本身异质性较高的限制。
国际颅底教授福教授
关于脊索瘤的新发现
2023年4月7日,福教授等相关研究人员在JNS上公布了他们关于脊索瘤的研究结果。在这项研究中,福教授等通过使用WES、靶向NGS和RNA测序(RNAseq)分析,提供了64个同类系列颅底和脊髓脊索瘤样本的详细基因组图谱,揭示了脊索瘤发展潜在的驱动事件、治疗诊断标记和结果相关的基因组特征。

方法:福教授等对2006年12月至2020年9月期间收集的64例颅底和脊髓脊索瘤样本进行了全外显子组测序(WES)、靶向二代测序和RNA测序,对临床、组织学和放射学数据进行回顾性分析。
患者特征:福教授团队,收集分析了62名原发性脊索瘤患者的临床、放射学和组织学特征。全部纳入的患者均为白人。平均随访时间为32.7个月(范围3.0-134.7个月,中位26.9个月)。19名患者(30.6%)之前曾接受过治疗,并因复发、未全切后或因肿瘤残留较大而不建议进行放疗而被咨询。总体而言,21名患者(33.9%)观察到肿瘤复发。无进展生存期(PFS)范围为2.3至99.3个月(平均23.1±16.8个月,中位19.4个月)。12名患者(19.4%)死亡。总生存期(OS)范围为3.0至134.7个月(平均30.2±23.5个月,中位26.1个月)。
研究结果
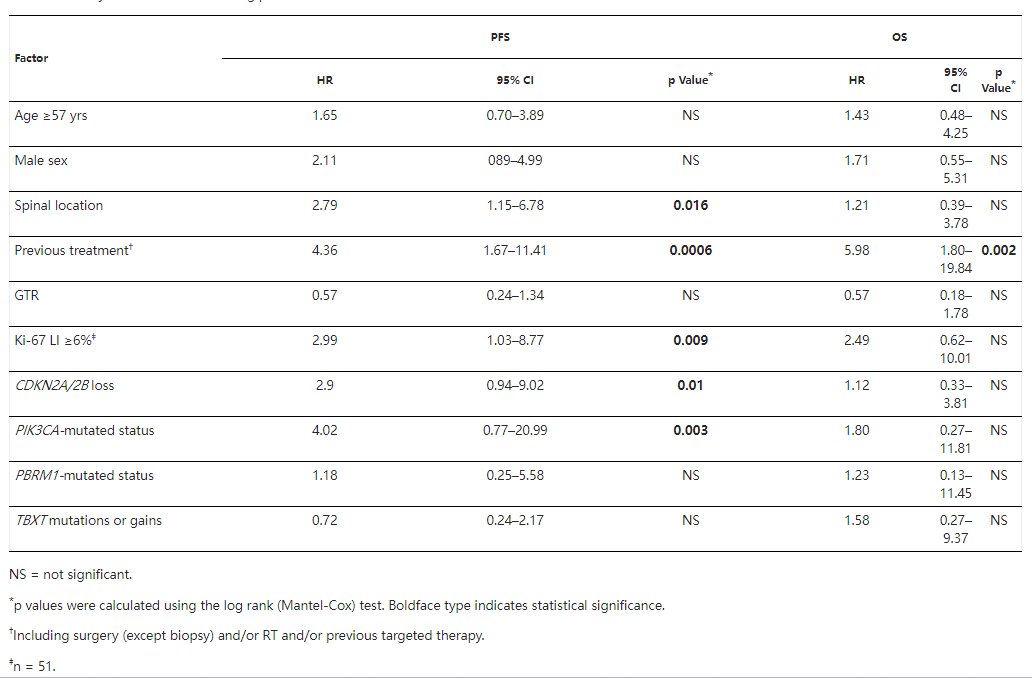
福教授等确定了以下基因的纯合缺失CDKN2A/2B的纯合缺失、PIK3CA突变以及影响SWI/SNF复合物改变(PBRM1和ARID1A)基因改变确定为潜在的治疗诊断生物标志物。使用匹配的种系WES,他们观察到与普通人群中的分布相比,TBXT中常见遗传变异(rs2305089;p.(Gly177Asp))的出现频率更高(97.8%,p<0.001)。PIK3CA突变被确定为短期无进展生存期的独自生物标志物(HR 10.68,p=0.0008)。CDKN2A/2B缺失在脊柱肿瘤和复发性肿瘤中更常见。
1、与其他已发表研究的结果一致,PBRM1突变和CDKN2A/2B纯合缺失是我们研究队列中观察到的较常见驱动事件。
2、PBRM1突变被描述为中国颅底脊索瘤人群的一个不良预后因素。在我们的研究中,未发现PBRM1与不良无进展生存期PFS或OS之间存在相关性。
3、SMARCB1或PBRM1等亚基的丢失会损害SWI/SNF复合物的稳定性,导致EZH2过度表达,EZH2是PRC2复合物的酶催化亚基,可通过组蛋白3(H3K27me3)赖氨酸的甲基化修饰。因此,通过他泽司他靶向脊索瘤表观遗传改变,是EZH2,似乎是一种有前途的治疗策略。此外,由于免疫刺激基因的富集,PBRM1失活似乎增强了对免疫治疗的反应,这表明免疫检查点控制剂(ICIs)的潜在影响。
4、在60例不同脊索瘤患者中,观察到影响SWI/SNF复合物和CDKN2A/2B缺失的突变的相互排斥性(p=0.001),导致将这两种改变视为脊索瘤的主要致癌机制。CDKN2A/2B缺失会导致CDK4/6过度激活。palbociclib(一种特定的CDK4/6控制剂)在脊索瘤细胞系和异种移植物中显示出有希望的抗肿瘤作用,强化了这种改变作为潜在的治疗诊断生物标志物。
5、该研究还观察到影响PI3K/AKT/mTOR信号通路基因的驱动事件频率相对较高,这在脊索瘤中已有报道,因此为继续探索靶向PI3K信号传导在脊索瘤治疗中的效用提供了理论依据。PI3K/AKT/mTOR通路是参与细胞生长、肿瘤发生、细胞侵袭和药物反应的重要细胞通路,已被认为是脊索瘤的潜在治疗靶点。一些mTOR控制剂已在临床前模型或晚期脊索瘤患者中进行了试验研究,但肿瘤缓解反应较差。近期,双重mTORC1/2控制剂AZD8055在临床前脊索瘤细胞系模型上显示出良好的体内抗肿瘤活性。此外,通过AZD8055控制mTOR增加了EGFR控制的功效,表明联合治疗策略在PI3K突变脊索瘤中具有良好的效果。
总而言之,数据表明,三分之一的脊索瘤的临床可成药物基因都观察到基因组学方面的改变。(our analysis revealed that one-third of chordomas(20/60)have genomic alterations in clinically druggable genes.)
6、即使在很大一部分人群中观察到rs2305089单核苷酸多态性(SNP),大多数人也不会发展为脊索瘤,这表明该SNP具有肿瘤细胞优势,并且需要其他分子机制来驱动脊索瘤发生。对脊索瘤细胞模型研究的观察也强化了TBXT在脊索瘤发生中的原始作用,在脊索瘤细胞模型中,TBXT控制可控制肿瘤生长。尽管初期的结果令人沮丧,但脊索瘤中brachyury的过度表达已成为活性疫苗的一个有吸引力的目标。然而,与疫苗无关,brachyury特异性T细胞的存在表明存在抗癌免疫力,这对于评估brachyury靶向疫苗与ICI药物之间的关联是令人鼓舞的。
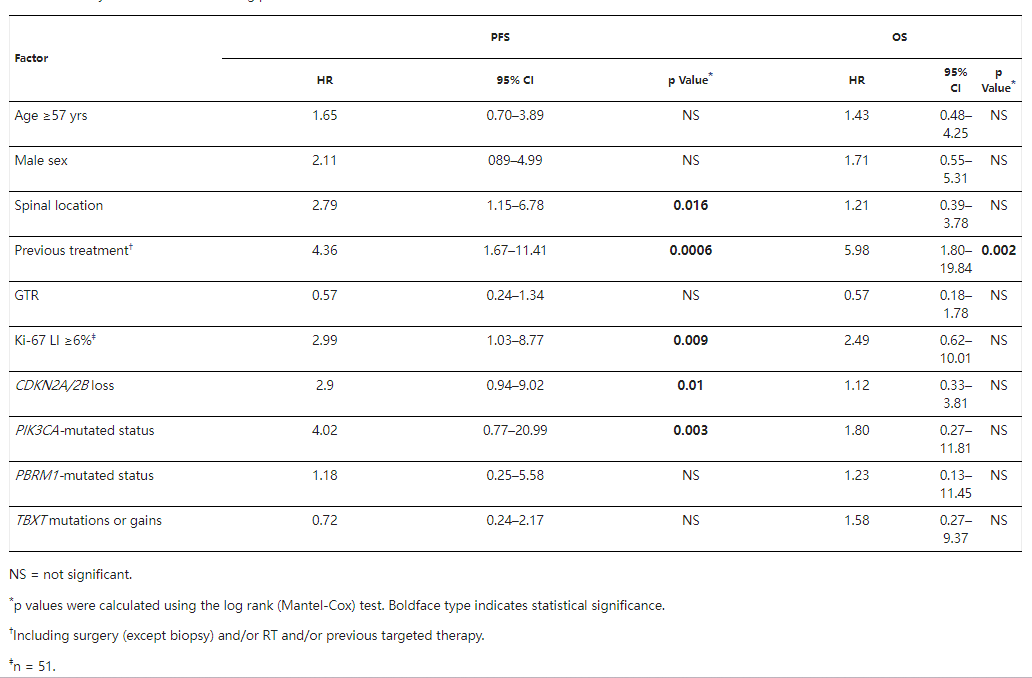
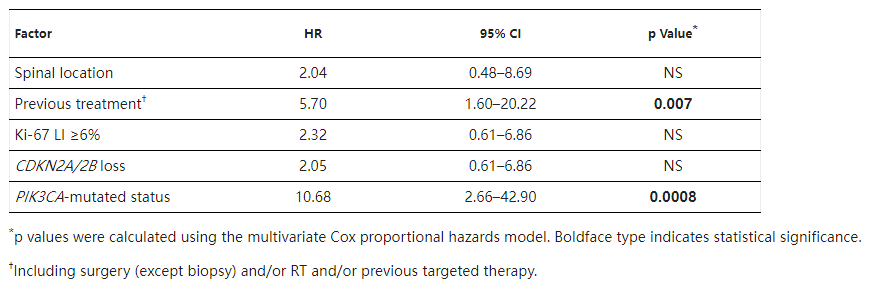
7、考虑到脊索瘤在生长概况和侵袭性方面的异质性,其对肿瘤的综合治疗管理具有挑战性。鉴于其复发率较高,在初次切除后关于术后放疗的决定,应考虑进一步进行治疗的必要性。事实上,在反复复发的情况下,反复的手术或放疗,并不总是能实现的,或者具有挑战性。此外,考虑到潜在的手术和放疗并发症风险,医生难以平衡治疗导致的并发症风险和生活质量的获益。尽管已经描述了许多临床、放射学或免疫组织学的相关预后因素,但对于治疗方面的分层尚难以予以明确的临床指导意见。因此,生物分子预后标志物对于判断不同类型的脊索瘤的治疗性至关重要。在我们的单因素分析中,除了ki-67生长指数、脊柱位置和既往治疗等经典预后因素外,11 PIK3CA突变和CDKN2A/2B缺失与较差的无进展生存期PFS相关(分别为p=0.003和p=0.01)。在我们的多因素分析中,PIK3CA突变是脊索瘤复发的独自不良预后因素(p=0.0008)、也与高转移率相关(p=0.02)。
详细研究数据分析
反复突变的基因:通过使用WES或靶向NGS分析60名不同的脊索瘤患者,获得了脊索瘤的全基因组学情况,并将致病性变异(PV)作为驱动事件进行管理(图1A)。
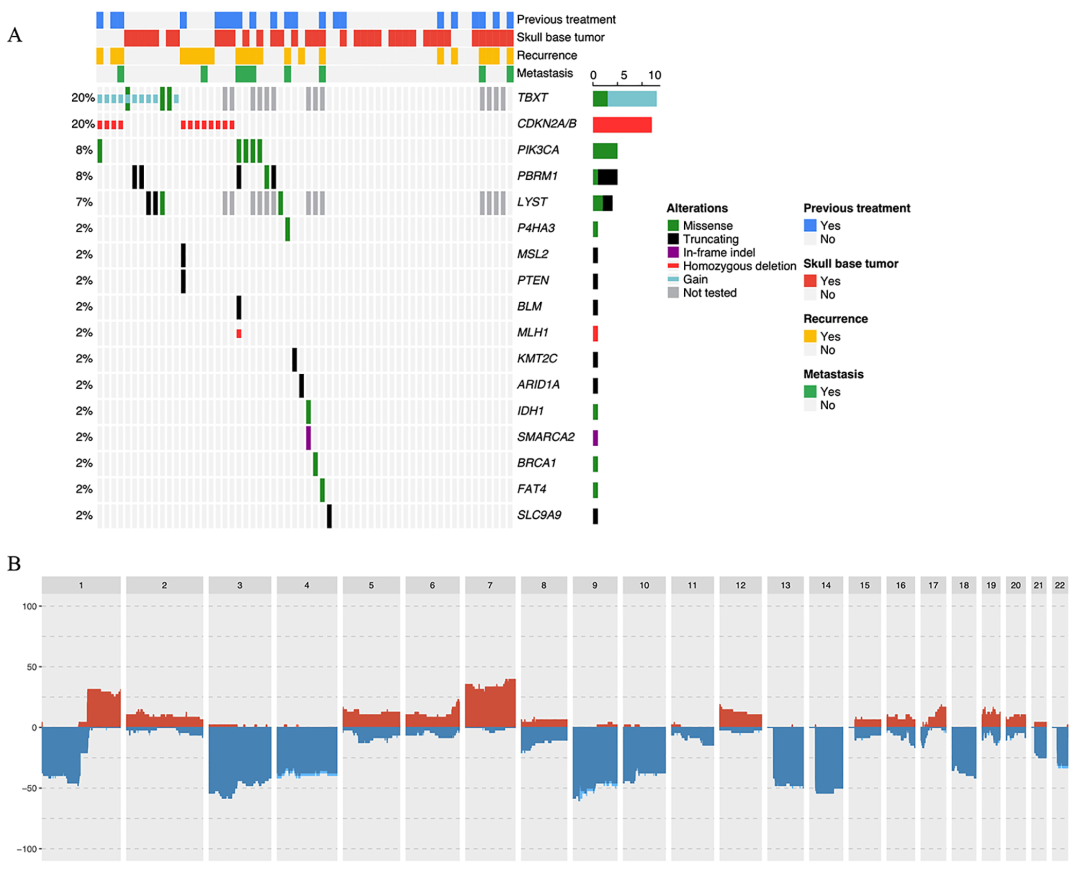
图示:通过WES或NGS分析60个脊索瘤样本的分子结果(A),代表脊索瘤的基因驱动事件。在每个肿瘤中,驱动事件由基因(行)和突变类型指示(参见关键字)。使用WES分析的46个脊索瘤的等位基因特异性拷贝数的编译基因组图谱(B)。该图表示在整个基因组中观察到的拷贝数增加或减少的比例(红色表示增加,蓝色表示杂合性损失)。CNV<-50%表示丢失2个等位基因拷贝(纯合缺失)。
原发性和复发性脊索瘤比较:对肿瘤(同一患者的原发肿瘤和局部复发肿瘤)进行WES。有趣的是,与原发肿瘤相反,这两个复发肿瘤具有CDKN2A和CDKN2B的纯合缺失(图2)。这一结果表明CDKN2A/2B缺失可能是肿瘤侵袭性的标志物,因为CDKN2A/2B缺失是CDK4/CDK6控制剂反应的已知生物标志物。
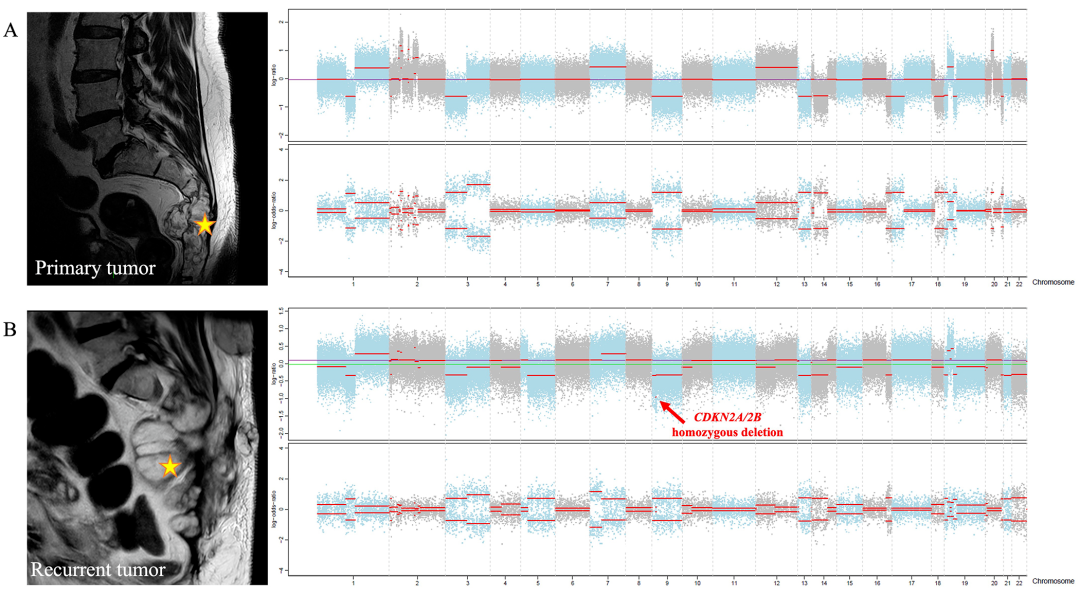
图示:骶骨原发性(A)与其局部复发(B)脊索瘤CNV特征之间的比较。我们在复发脊索瘤中观察到CDKN2A/2B的纯合缺失(红色箭头)。黄色星星表示脊索瘤。
与患者特征和预后相关的驱动基因事件:在使用WES或靶向NGS分析的60名患者中,我们分析了4种较常见的基因组改变与临床特征之间的相关性。脊柱位置比颅底位置更常与CDKN2A/2B丢失相关(p=0.008)。女性患者比男性患者更频繁地发生TBXT事件(增益或SNV)(p=0.003)。CDKN2A/2B损失与Ki-67生长指数≥6%之间存在相关性(p=0.01)。
脊柱位置(p=0.016)、既往治疗史(p=0.0006)和Ki-67生长指数≥6%(p=0.009)与不良无进展生存期PFS具有统计学相关性。仅接受过既往治疗的患者的OS低于未接受治疗的患者(p=0.002)。CDKN2A/2B缺失和PIK3CA突变状态与较短的PFS相关。
脊索瘤患者无进展生存期PFS和OS的单因素分析:
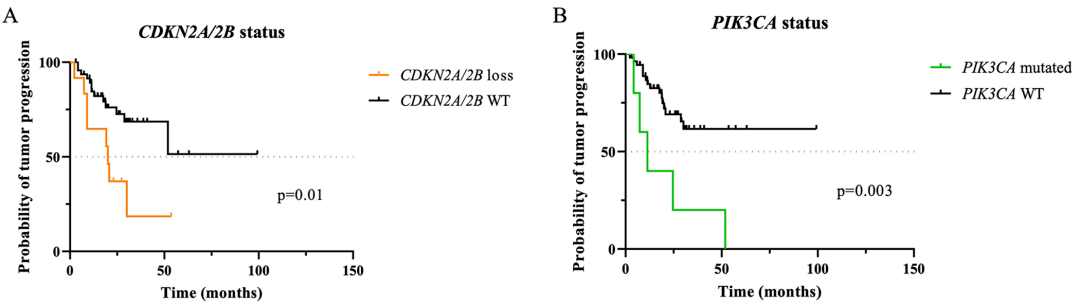
图示:60个相应脊索瘤样本中CDKN2A/2B缺失(A)和PIK3CA突变状态(B)对无进展生存期PFS的预后价值(单变量分析)。WT=野生型。
成对原发性和复发性比较:对2对肿瘤(同一患者的原发肿瘤和局部复发肿瘤)进行WES,测序深度相同。有趣的是,与原发肿瘤相反,这两个复发肿瘤具有CDKN2A和CDKN2B的纯合缺失(图2)。这一结果表明CDKN2A/2B缺失可能是肿瘤侵袭性的标志物,因为CDKN2A/2B缺失是CDK4/CDK6控制剂反应的已知生物标志物。
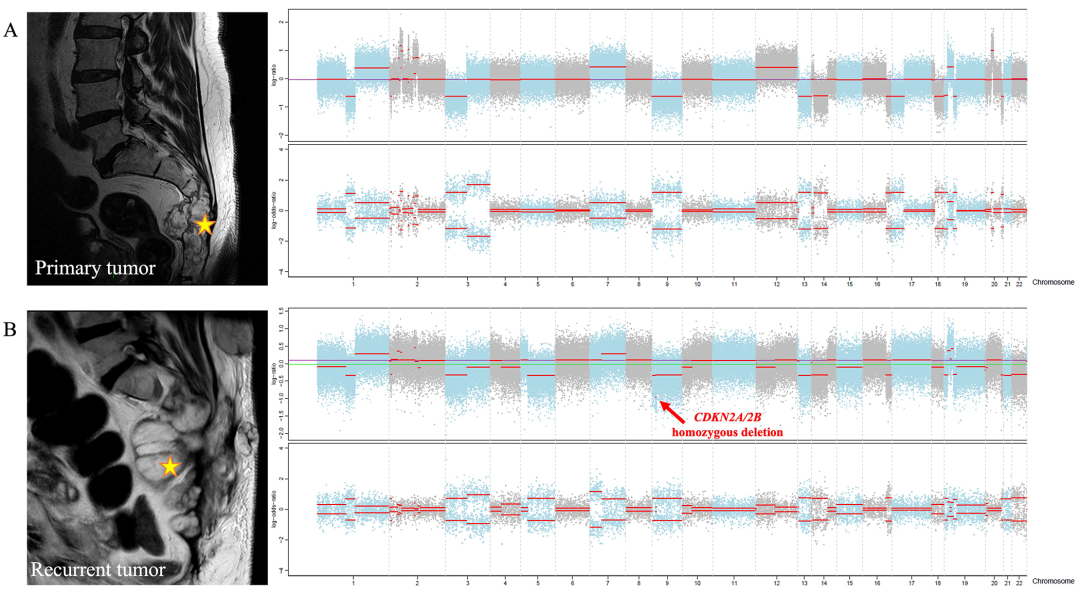
图示:骶骨原发性脊索瘤(A)与其局部复发(B)的CNV特征之间的比较。我们在复发肿瘤中观察到CDKN2A/2B的纯合缺失(红色箭头)。黄色星星表示肿瘤。
与患者特征和预后相关的躯体驱动景观:在使用WES或靶向NGS分析的60名患者中,我们分析了4种较常见的基因组改变与临床特征之间的相关性。脊柱位置比颅底位置更常与CDKN2A/2B丢失相关(p=0.008)。女性患者比男性患者更频繁地发生TBXT事件(增益或SNV)(p=0.003)。CDKN2A/2B损失与Ki-67标记指数≥6%之间存在相关性(p=0.01)。
脊柱位置(p=0.016)、既往治疗史(p=0.0006)和Ki-67标记指数≥6%(p=0.009)与不良PFS具有统计学显着相关性。仅接受过既往治疗的患者的OS显着低于未接受治疗的患者(p=0.002)。CDKN2A/2B缺失和PIK3CA突变状态与较短的PFS显着相关。
脊索瘤患者PFS和OS的单因素分析
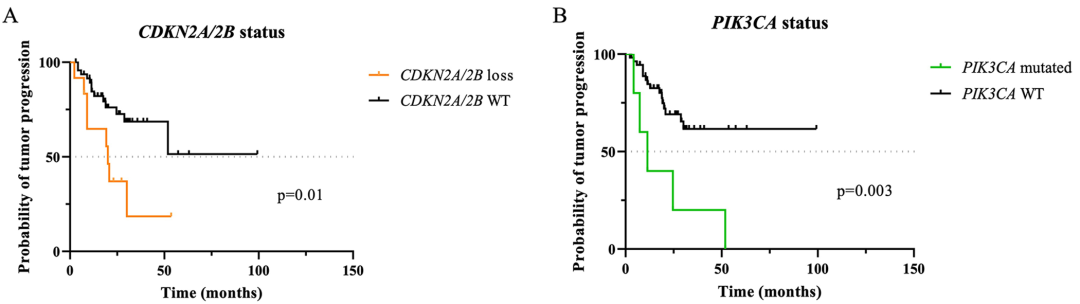
图示:60个相应脊索瘤样本中CDKN2A/2B缺失(A)和PIK3CA突变状态(B)对PFS的预后价值(单变量分析)。WT=野生型。
在我们的多变量分析中,只有PIK3CA突变状态和既往治疗是PFS的独自评估因素无进展生存期生存分析。
RNA分析:根据基因表达图谱观察到2个聚类(A、B)。与B组(n=17)相比,A组(n=20)的脊髓脊索瘤比例较高,而B组的颅底脊索瘤比例较高(p=0.003)。两组之间的无进展生存期PFS没有差异(p=0.44)。在差异分析中,我们测试了Reactome数据库(https://reactome.org)产生的一组基因的富集。正如预期的那样,我们发现该组细胞周期基因富集,Ki-67生长指数≥6%(p=6.84e-09)。关于脊索瘤的位置、随访期间的复发以及之前的治疗,没有发现的富集。
热图表示2000个基因的聚类,每个基因具有较高方差。每列代表一个肿瘤,而每行代表一个基因。根据基因表达谱观察到两个大簇(A、B)。
结论
在当前的研究中,福教授团队确定了脊索瘤发生发展的驱动基因事件,如PBRM1突变、PIK3CA突变、TBXT改变或CDKN2A/2B的纯合缺失,这些事件可能被认为是潜在的治疗通路或靶点,并且可以确定具有较大潜力的新治疗方法。在对脊索瘤预后方面,PIK3CA和CDKN2A/2B突变可被认为是预后不良的生物标志物。




