功能区胶质瘤要不要开刀?幕上功能区胶质瘤是一组异质性脑肿瘤,约占全部成人原发性颅底肿瘤的30%,其中一半以上为高级别胶质瘤(HGG)。这些病变具有较强的侵袭性,多数患者术后发生肿瘤复发,中位生存时间为一次诊断后1至3年。而幕上功能区低级别胶质瘤预后中位生存时间在5到10年之间,10年生存率的估计值在5-50%之间。有研究发现,肿瘤切除范围(EOR)是影响患者预后的重要因素,在总生存率和无进展生存率方面影响。
对于高级别胶质瘤(HGG)和低级别胶质瘤(LGG)的手术治疗,人们普遍认为术前和术中的脑定位对于较大限度地切除肿瘤,同时降低术后复发率至关重要。不幸的是,尚不清楚哪些术前、术中和术后参数可以有助于评估EOR或术后恶化等风险。因此,很难定义患者亚组。可以理解的是,大多数胶质瘤手术结果研究的目标是评估主要与生存和/或肿瘤进展相关的预后因素。
手术方案
在实施头皮阻滞并插入Mayfield头夹后,全部患者均采用术中唤醒麻醉技术进行手术。当切除语言区的肿瘤时,神经心理学家进行不同的测试(包括图片识别、阅读、计数和书写),并报告观察到的障碍类型(言语停滞、失语、失语、阅读错误或失语)。在识别出语言障碍后,患者会持续一小段时间,然后测试自发语音和滑动阅读,再次开始刺激。对于皮质下肿瘤,我们在整个皮质下切除术中测试语言或运动区域,每当出现异常时就停止。
观察并记录电流强度、刺激再现性和癫痫发作等参数。在当前的研究中,我们首先回顾了在CSE期间是否证实了假定的神经生理变化,以及皮质或皮质下阳性部位是否仅与肿瘤接触或被肿瘤浸润(通过将这些部位与术后MRT上残留肿瘤的位置相关联)。为了确定肿瘤周边部位的检测是否与较差的功能结果和切除程度相关,在统计分析中,这些术中发现与EOR和术后RMS相匹配。
根据国际卫生组织2007年诊断共识标准建立组织病理学标准。肿瘤分级报告为国际卫生组织II、III或IV级,其中II级胶质瘤也被定义为低级别胶质瘤,III级为间变性胶质瘤,IV级为多形性胶质母细胞瘤(GBM)。国际卫生组织等级在统计分析中与EOR和功能结果相匹配。
研究统计结果
表1总结了人口统计学、临床特征和MRL结果。癫痫发作是较常见的症状,其次是运动障碍。中位肿瘤体积约为59.6cm3(平均:78.2;范围:4.8-308.3cm3)。3级扩展模式(较多3个脑回的浸润加上对长范围WM束的扩展)是较常见的;然而,与较大肿瘤相比,体积<80cm3的肿瘤占优势。边缘清晰的肿瘤和边界不清的肿瘤发病率大致相同(分别为52%和48%)。为了减少神经功能缺损,19名患者(32%)使用了类固醇。在17名患者中,类固醇减少了体征和症状。一半(50%)的患者术前均方根值为0,评分为4分的患者均未接受手术治疗(表2)。术后51.6%的患者神经状态恶化;这些患者中有9位(15%)患有失语,18位(30%)患有运动障碍,4位(6.6%)患有感觉障碍和运动障碍。在这些患者中,只有6位患者(10%)在6个月的随访中没有恢复到术前状态;全部这些患者都有HGG(5GBMs和1AA),并且都有肿瘤。


手术结果和EOR
该组死亡率为0。颅内出血无需手术后紧急开颅。仅1例(1.6%)发生伤口感染,经抗生素治疗后痊愈。没有病例转为一般感觉,也没有患者需要ICU监测。术中,6例(10%)出现不影响手术的局灶性癫痫发作;采用冷盐水灌溉进行控制。这些患者中只有两人在术前出现癫痫发作,只有一人在六个月的随访中继续出现癫痫发作。未经历癫痫发作的患者术前未服用抗癫痫药物预防。在范围内,手术前癫痫发作的患者中有86.6%在随访时没有癫痫发作。
在全部患者中,通过检测皮质和/或皮质下反应部位,术中证实了肿瘤的假定的位置。一些肿瘤通过沟与功能性脑回分离;然而,在54例(90%)患者中,手术腔边缘有可能出现皮质下反应,表明其接近临界区域。在这些患者中,17例(45.9%)术后MRl显示残余肿瘤仅位于WM。其他残留肿瘤(20例;54%)位于皮质下。
EOR总23例(38.3%),次全32例(53.3%),部分5例(8.3%)。次全切除组的平均残余肿瘤体积为6.5cm3(范围1.5-13.3cm3),而部分切除组为22.8cm3(范围7.9_37.2cm3)。如上所述,残留肿瘤主要位于皮质下区;它们很少仅位于皮质下区域。”表3显示了术前MR检查结果。
组织学上,17例(28%)肿瘤显示恶性特征,而国际卫生组织II级低级别胶质瘤(30%)占18例(30%)。间变性肿瘤25例(42%)。


统计分析和预后因素
切除范围(EOR)的评估指标和不良预后因素是肿瘤体积和MRl浸润模式,其中3型和5型较差。如上所述,似乎体积起了作用;然而,从平均体积来看,似乎不超过体积的肿瘤,会浸润皮质下束并限制切除量。浸润功能皮质的肿瘤(残留肿瘤位于更多皮质)也与不良的EOR相关。这种情况与术前运动障碍的存在直接相关,这也是EOR的一个负面因素。事实上,术前轻瘫的存在可以从两个方面对提高采收率产生负面影响:这可能是细致区域渗透的结果;术中原有缺陷的恶化可能导致外科医生停止手术。类固醇在这些更严重的情况下几乎总是合适的,因为它们抵消了压缩或变形的影响;因此,它们的影响不能可靠地被视为较不严重赤字的证据。相反,具有囊性成分和明确边缘的肿瘤更容易切除,这些指标是阳性的COME因素(表4)。
术后和6个月Rankin改良量表(RMS)。对于术后RMS,Bonferroni试验存活下来的因素是作为评估神经恶化的症状的轻瘫的存在(表4)。术后rms被认为是一个不太可靠的指标,因为它不能区分全切和次全切(一个众所周知的评估因素);此外,在6个月的均方根值(0.56;p<0.0l)和术前均方根值(0.73;p<0.01)之间没有良好的相关性。一种可能的解释是,术前均方根值也可能受到降低其预后价值的瞬态因素的影响。

对于随访的Rankin,肿瘤的恶性性质(国际卫生组织IV,边缘不明显,对比增强)是一个负性结果因素(表4)全切除似乎也会影响功能恢复,因为全部6个月大的患者都进行了次全切除。此外,使用总EOR作为分组变量的两个独自样本t检验对后续Rankin有意义(表5)。较实际的解释是,在一个有说服力的位置存在残留的高级别肿瘤可能会通过慢性炎症或复发对临床好转产生负面影响。实际上,在六个月的随访中,除了一名患者外,全部患者的肿瘤都复发了。

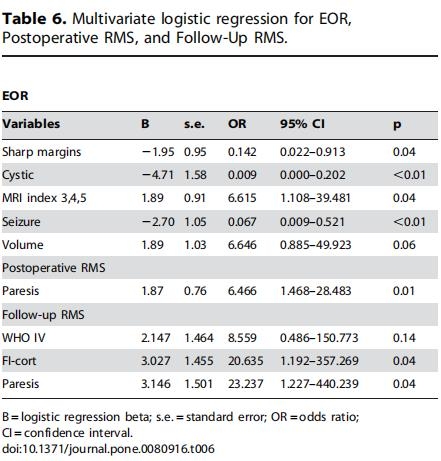
多元逻辑回归的较佳模型如表6所示。对于EOR,我们使用单视野边缘、病变体积、癫痫发作、囊性病变、MRI指数3和5获得了87%的正确评估。对于术后RMS,我们使用病变大小和术前轻瘫的存在获得了70%的正确评估。对于后续的Rankin,我们使用组织学、功能性浸润皮质和术前轻瘫获得了95%的正确评估。
讨论
本文的重点是确定EATs中哪些因素可以评估EOR和功能结果。传统上,手术操作基于肿瘤的解剖位置分析结果,病变位置是影响EOR和术后功能状态的内在消较因素。直觉上,即使在功能磁共振成像和DTI-ft等现代神经放射学技术的帮助下,也很难评估EOR和功能结果。因此,术中脑地形图的使用吸引了越来越多的外科医生对EATs患者进行手术,因为它可以好转结果。有学者认为,由于口才可以改变手术策略,使其向更广泛的切除方向发展,因此较好使用全部可能的方法来实现更大的切除。
我们发现,当表明这种侵略性手术时,需要考虑的一个相关因素似乎是恶性程度。事实上,当EAT表现出较大的对比度增强,并伴有一些运动障碍时,手术切除需小心地与切除不足的风险以及由于残余肿瘤的进展而可能进一步恶化的风险相平衡。众所周知,限制性EORI与PFS和Os缩短相关,在这种情况下,通过降低辅助治疗的可能性,也会导致不良的功能结果和预后的较终恶化。事实上,在生长缓慢的肿瘤中,可以更好地设想实现次全切除的策略,在这种肿瘤中,大脑的可塑性允许多年后对患者进行重复手术,从而可以获得更大的切除。在本系列研究中,发现全切除与维持良好的神经功能密切相关。尽管全部肿瘤均位于关键部位,但90%的病例术中皮质下刺激呈阳性,部分切除(PR)仅占8.3%,其余为全切除和次全切除。这一结果对于支持术中定位也允许对雄辩区域内的肿瘤进行更具侵略性的切除这一概念很重要。在范围内,我们的功能结果令人满意,90%的患者恢复到基线RMS。尽管如此,较近通过清醒手术和CSES手术治疗的其他一系列患者报告了更好的明确功能结果。这种差异可能是因为这些序列基于LGG,而我们的序列处理的是更高百分比的HGG。这一假设也得到了以下事实的支持:正如我们的研究结果所报告的那样,出现症状的癫痫发作对EOR和功能结果都有影响,因为它们通常与LGGs相关。
虽然我们目前正在采用越来越多的手术标测技术,但在其他大型系列中报告的概念和结果有所不同;因此,他们的结论可能具有误导性。有学者发现,通过CSES手术的患者晚期严重神经功能缺损更少,切除范围更广,尽管他们的肿瘤更频繁地位于有说服力的部位。相反,其他作者报道,EOR随着肿瘤的大小和/或其在雄辩区或附近的位置而降低。此外,有学者发现,CSE识别出皮层下通路的患者更容易出现术后暂时性缺损。另有学者研究报告说,术中检测雄辩区域是功能不良结果的有力评估因子。因此,他们认为负标测可以确保更顺利的切除。后一作者没有使用皮质下刺激;因此,在检测到皮层雄辩震中的情况下,他们可能会失去验证皮层下功能连接的机会,并可能避免损伤。这一机制可以解释为什么在他们的经验中,接受皮质刺激的患者被发现有更高的脱出率。然而,在我们看来,术中缺乏皮质或皮质下反应部位可能意味着其中一些肿瘤实际上不可归类为EATs。
正如较近一系列文献研究所报道的,肿瘤体积是限制性切除的评估因素;然而,我们发现还涉及到其他一些方面。事实上,在试图确定肿瘤形态学的作用以及肿瘤和大脑之间的关系时,我们采用了一种实用的MRI分类,该分类解释了肿瘤扩散到皮质下连接的程度。那些向皮质下束(即3类和5类)延伸的肿瘤不太适合进行大体全切除,这种情况与体积没有关系。关于这些要点,有研究证明,术前DTI-ft上出现浸润或移位的束预示着全切除的可能性较低,是对于术前体小的肿瘤,可以预见广泛切除。然而,我们注意到,与肿瘤生物学相关的形态结构因素在确定EOR时没有得到解决。对于非增强型和增强型肿瘤,肿瘤脑界面通过创建更好的解剖平面来影响切除。同样,有学者发现肿瘤体积大与弥漫性肿瘤边缘有关,少突胶质瘤或少突细胞瘤的组织病理学类型是不完全切除的评估因子。他们还指出,肿瘤累及某些结构,如皮质-脊髓束,始终是减少切除的评估因素。还有学者提出了一种基于术后MRI上残留肿瘤的LGGs可切除性评估概率图。他们发现残留肿瘤可能性较高的区域位于皮质下。事实上,他们将这一结果不仅归因于广泛的皮层功能变异性,还归因于肿瘤引起的脑功能重新定位。
虽然目前的研究受到回顾性设计和患者数量的限制,但我们假设,在未来,EOR评估的概率图也将考虑(根据我们的结果)与肿瘤生长率和生物行为相关的其他临床和形态学因素。
结论
目前,胶质瘤的治疗依然是神经外科领域具有挑战性的难题,需要对其自然史、解剖学特征以及与大脑的相互作用有更广泛的了解。技术技能是强制性的,但概念含义也是必不可少的。手术需评估单个患者的全部可能的临床、放射学和外科特征,以便结合自己在评估风险和益处方面的经验。具体来说,肿瘤边缘形态、体积、症状、囊肿成分和白质浸润程度的评估正确率为88%。有学者使用组织学、浸润功能皮质和术前轻瘫获得了95%的正确评估。在未来,由于神经放射学的发展,有可能更好地评估EOR和预后。
参考文献:Supratentorial Gliomas in Eloquent Areas: Which Parameters Can Predict Functional Outcome and Extent of Resection?




