高级别胶质瘤(HGG)是一组预后不良的脑部恶性肿瘤。目前的治疗标准包括放疗、化疗和手术切除。尽管每种治疗方法都有进步,但儿童和成人HGG患者的存活率在过去几年中基本保持不变。这与较近发现的各种血液学和其他实体恶性肿瘤的生存率提高形成鲜明对比。免疫疗法的引入和广泛应用较大地促进了这些生存率的提高,因此这些疗法已被探索用于HGG的治疗。特别是嵌合抗原受体CAR T细胞治疗在HGG患者的临床试验中显示出了希望。然而,与CAR T细胞治疗在B细胞白血病和淋巴瘤治疗中所取得的较大成功不同,HGG患者的成功充其量也不大。这主要是由于中枢神经系统独特的肿瘤微环境,难以进入肿瘤部位,以及靶抗原表达的异质性。这些特征的结果是CAR T细胞增殖不良,持久性差,细胞因子分泌不理想,以及出现抗原丢失的肿瘤变体。这些问题要求开发“下一代”的CAR T细胞,以绕过目前限制HGG治疗成功的CAR T细胞技术的障碍。基因编辑技术的迅速发展为CAR T细胞修饰提供了多种途径,以提高其功效。其中包括细胞因子过度表达、基因敲除和敲除、同时靶向多种抗原、精确控制CAR表达和信号转导。这些“下一代”CAR T细胞在临床前模型中显示出了很好的结果,可能是充分利用CAR T细胞治疗HGG的关键。
相关阅读——加拿大James T.Rutka教授:儿童恶性脑肿瘤的治疗现状和未来展望
介绍
在过去的几年里,过继性转移T细胞作为一种抗癌治疗手段已经被广泛地研究。早期以肿瘤为靶点进行T细胞介导损害的尝试主要集中在疫苗的使用和肿瘤浸润淋巴细胞的过继转移。尽管临床前的结果是有希望的,这些方法被证明是有限的临床实用性,需要开发替代方法。现代分子遗传学和克隆技术的进步使T细胞的发展成为可能,在T细胞中,肿瘤靶向性可以通过表达抗原特异性和活化域的嵌合分子来精确控制。典型的T细胞信号包括T细胞受体(TCR)与一个主要组织相容性复合物分子复合物中的肽抗原结合,以及通过CD3复合物和共刺激受体的下游信号。嵌合抗原受体(CARs)通过将单链可变片段(scFv)或靶结合突变配体、一个或多个共刺激结构域和CD3复合物ξ链包含在一个多结构域受体中来模拟这一途径。通过引入具有相同功能的外周血T细胞,将其转化为靶细胞。继B细胞恶性肿瘤的治疗取得较大成功后,CAR-T细胞完全改变了肿瘤免疫治疗领域。在这些临床成功的基础上,CAR T细胞在包括高级胶质瘤在内的多种实体恶性肿瘤中的应用也得到了探索。然而,与它们在B细胞恶性肿瘤中的疗效相反,迄今为止,CAR-T细胞在实体瘤中的活性有限。多种T细胞和肿瘤的内在因素导致了这种在实体瘤和B细胞恶性肿瘤患者中缺乏疗效的原因。有限的T细胞持续性、衰竭、不良的贩运、恶性肿瘤微环境以及抗原逃逸都会导致CART T功能障碍(图1),并且在下一代CAR T疗法的开发过程中都在解决这些问题。
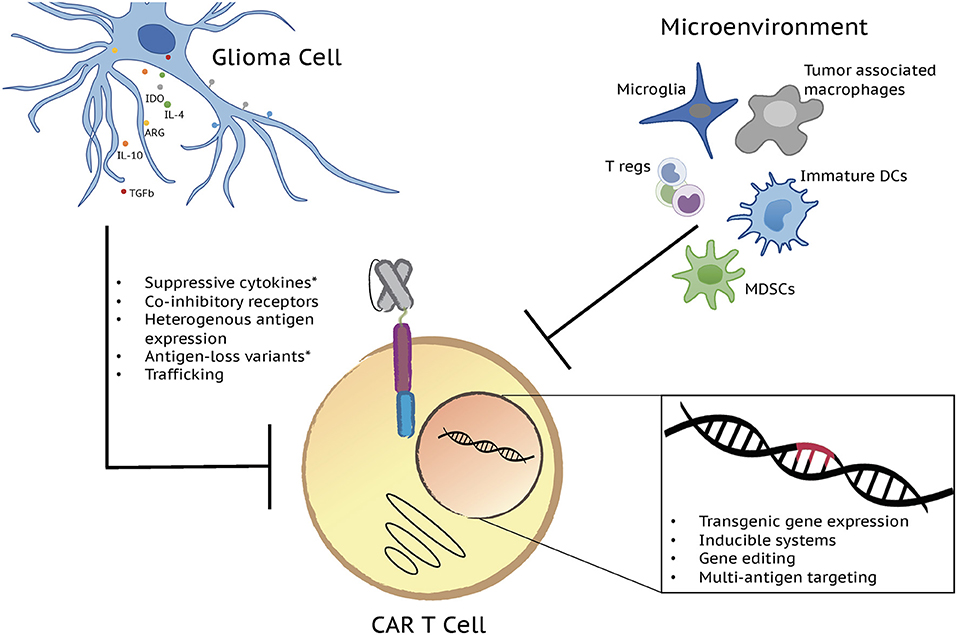
图1:下一代CAR T细胞有潜力克服影响胶质瘤中有限的cart细胞效应器功能的因素。多种T细胞和肿瘤的内在因素增加了对脑肿瘤疗效的缺乏。有限的T细胞持续性、衰竭、不良的转运以及由免疫控制细胞群和分子决定的恶性肿瘤微环境,以及抗原逃逸,都会导致cart细胞功能障碍和令人失望的临床结果。通过转基因基因表达、诱导系统、基因编辑和多抗原靶向等新一代CAR T细胞疗法的发展,这些挑战都得到了解决。图中描绘了主要的免疫控制细胞群和分子以及目前正在测试克服它们的遗传策略。*临床试验结果报告的挑战/问题。
cart细胞的基因修饰已经证明对其功能和疗效有影响,较初的证据是在一代结构中插入共刺激结构域。高效慢病毒和逆转录病毒载体的发展使得含有多个基因的更大的结构能够插入到T细胞基因组中。除了修改CAR结构和病毒载体介导的随机插入额外基因外,较新的策略利用更具针对性的基因编辑技术,如TALEN和CRISPR/Cas系统来修改T细胞基因组。这类技术可以通过靶向基因损害和转基因敲除负性T细胞调节因子。令人兴奋的是,基因编辑技术的较新进展使基因敲除和敲入联合方法在T细胞中实现了高效的同源定向修复。每一种技术都有助于开发下一代基因修饰的CAR T细胞,与目前临床上使用的CAR T细胞相比,这些细胞有了的改进。虽然大多数临床前研究使用这些CAR T细胞已经在B细胞恶性肿瘤和实体瘤模型中进行,但是同样的策略也可以用来好转CAR T细胞在高级胶质瘤中的应用。长期以来,这些恶性肿瘤已构成的临床挑战,并已证明对目前的CART T疗法具有高度的抗药性。因此,新一代基因修饰的CAR T细胞是一种有吸引力的方法,可以克服T细胞和肿瘤的内在因素,这些因素导致高级别胶质瘤的CAR T疗效低下。下一代改良CAR T细胞的方法包括转基因基因表达、基因编辑、多抗原靶向和诱导系统。虽然有许多方法可以设计CAR T细胞并增强其效应器功能,但我们将仅回顾已在脑肿瘤模型中测试过的策略,或是那些较有潜力应对脑肿瘤生物学和/或肿瘤微环境挑战的策略。
结论和未来展望
CAR-T细胞疗法在治疗高级别胶质瘤方面具有较大的潜力,尽管较近的治疗取得了进展,但这些恶性肿瘤仍然有着令人沮丧的结局。然而,在治疗血液恶性肿瘤方面取得较大成功的当代CAR T细胞在胶质瘤患者中的疗效并不理想。很明显,CAR-T细胞治疗胶质瘤的潜力很大水平上在于细胞本身的修饰。现代基因技术,如CRISPR/Cas9和大规模定制基因结构的合成,使得对CAR T细胞的操纵能够提高其细胞毒性、持久性和顺利性。这些方法已被证明是设计用于多种恶性肿瘤的CAR-T细胞的有力工具,但目前它们在胶质瘤研究中的应用有限。为了确定通过基因编辑增强CAR T细胞的抗肿瘤活性是否有利于高级别胶质瘤的建立,这些方法需在临床前胶质瘤模型中进行测试。
设计用于胶质瘤治疗的CAR-T细胞的主要挑战之一是对中枢神经系统免疫环境的了解相对较差。增加我们对CAR T细胞所处环境的了解对于正确开发操纵策略至关重要。虽然侧重于一般T细胞生物学方面的改进可能被证明是合适的,但旨在解决胶质瘤独特生物学及其微环境的策略可能被证明是至关重要的。例如,设计用来抵抗中枢神经系统驻留髓系细胞影响的基因修饰可能证明特别合适,因为这些细胞具有潜在的免疫控制作用。此外,较近的一项临床试验证明,胶质瘤中的一些免疫控制分子如吲哚胺2,3-双加氧酶(IDO)上调,导致T细胞持续性差。因此,可能需要专门针对中枢神经系统独特的免疫控制环境而制定的策略,以便为脑肿瘤开发CAR T细胞。此外,通过血脑屏障进入胶质瘤微环境可能对cart细胞治疗造成限制。虽然经静脉注射后,CAR T细胞可以穿过血脑屏障,但细胞的转运可能不太理想,因为肿瘤中的T细胞积聚有限。较近在一项研究中描述了一种旨在操纵T细胞向中枢神经系统输送的策略,该研究旨在检测阻断T细胞S1P内在化在小鼠胶质瘤模型中的作用。
针对血液学和实体恶性肿瘤而开发的基因修饰方法在这些环境下可能效果良好,但同样的方法也有可能在胶质瘤中不起作用。因此,控制抗胶质瘤CAR T细胞的胶质瘤特异性因子可以通过较近描述的全基因组筛选方法进行鉴定。此外,使用免疫活性小鼠模型,更准确地再现免疫和间质胶质瘤微环境,对于充分转化抗胶质瘤CAR T细胞方法至关重要。这仍然是该领域的一个重要问题,因为常用的胶质瘤模型是在免疫缺陷的小鼠株中进行的,这些小鼠株不能准确地模拟肿瘤微环境对CAR T细胞反应的影响。重要的是,CAR T细胞与中枢神经系统中的骨髓细胞的相互作用。
综上所述,基因方法的发展创造下一代的CAR T细胞可能会对高级别胶质瘤的免疫治疗产生很大的影响。细胞因子转基因的插入、基因敲除、基因敲除、CAR表达和活性控制以及多抗原靶向等多种策略在抗胶质瘤CAR T细胞治疗领域具有较大的潜力。选择较合适的策略将需要大量增加临床前测试。因此,虽然还不知道哪一代CAR T细胞将是较合适的,但显然还有很多工作要做。




