2012 年中国肿瘤登记报告指出,中国脑及中枢神经系统恶性肿瘤病死率为3. 87 / 10 万,其中,胶质瘤占中枢神经系统CNS恶性肿瘤81% 。 脑胶质瘤严重危害人的健康,目前的治疗仍是以手术治疗为首要 原则 ,术后辅助放化疗,然后肿瘤的高度恶性使得预后很差,。 随着分子肿瘤学研究的发展,2016 年5 月,国际卫生组织WHO发布四版(修订)的CNS肿瘤分类,一次推出整合了组织学表型和基因表型的CNS肿瘤分类。 根据WHO的CNS肿瘤新分类和当前的研究热点,本文对脑胶质瘤分子基因检查及 分子靶向药物治疗胶质瘤进行详细解读。
胶质瘤分子标志物解读
近年来,神经肿瘤分子病理取得了进展,目前已发 现一系列有助于脑胶质瘤临床诊断和预后判断的分子标志物。 目前的WHO病理分级仍然依赖形态学进行肿瘤分级,然而,有 充分的证据表明,组织特征相同或相似的胶质瘤可以具有不同的分子遗传学背景,导致WHO分级相同的个体间预后有着较大差异。基于肿瘤遗传学水平的分子病理分型能够更准确地判断 临床预后;并且对组织学上较难鉴别的混合性胶质瘤(少突星形 细胞瘤和间变性少突星形细胞瘤)还能帮助明确诊断和分级。 另外,这些新近发现的分子变异有可能成为未来治疗的新靶点。
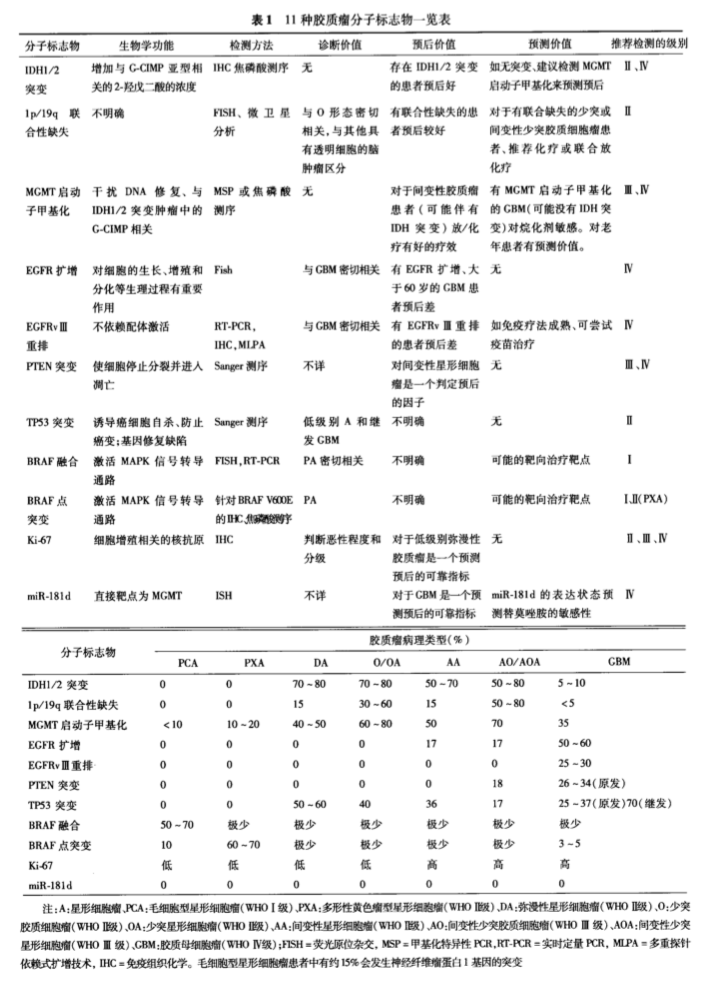
(图:11种胶质瘤分子标记物一览)
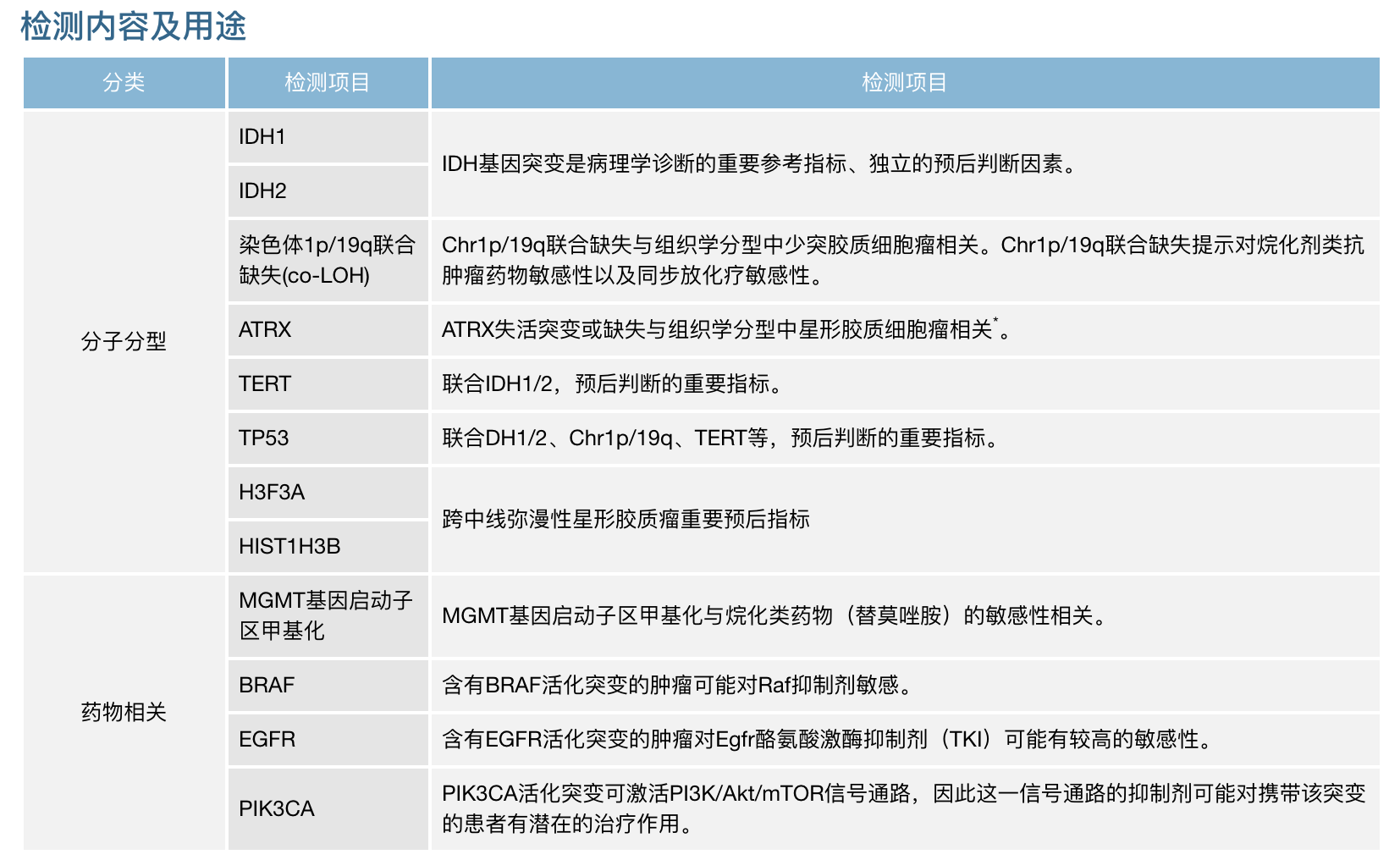
(图:胶质瘤常用检测分子 及意义总结)
近10年来,脑胶质瘤的基础和临床研究有了较大突破,进一步了解胶 质瘤的分子生物学特征,通过l临床试验明确更多潜在的分子标 志物,有望揭开脑胶质瘤病理生理和发病机制的神秘面纱。除 了种族、性别、年龄、生活习惯等临床常见因素,重要的分子标志 物的筛选,对临床胶质瘤 进一步病理分型的诊断、治疗 及预后判断等均有深远的意义。
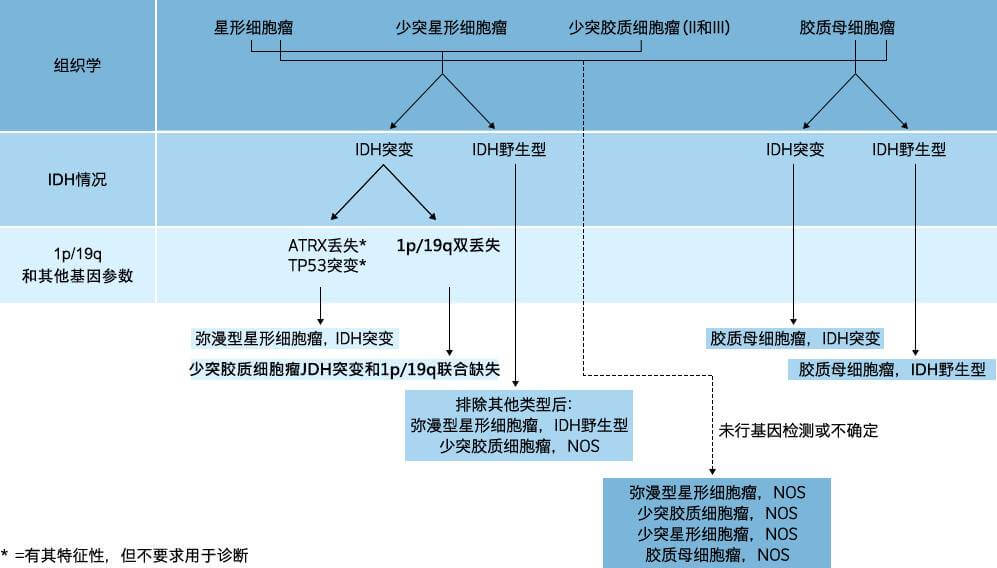
图:胶质瘤分子基因诊断图示
参考资料:
中国脑胶质瘤分子咨询指南.
分子靶向药物治疗脑胶质瘤的研究进展.




