脑肿瘤多种多样,
但一般从性质上来说,都有良恶性之分。
其中,胶质瘤在我国年发病率为3-6人/10万人,
属于脑肿瘤里的最“活跃分子”。
得了胶质瘤,如何判断是良性的还是恶性的?
关于胶质瘤
胶质瘤是最常见的脑瘤,根据脑胶质细胞瘤的组织结构和细胞特征,在显微镜下观察术中或术后胶质瘤的病理分级。胶质瘤的病理分级方法有几种,1级通常为低级-例如毛细胞星形细胞瘤;2级扩散浸润,但低级;3级包括间变性星形细胞瘤,间变性室管膜瘤,间变性少突胶质细胞瘤和间变性少星形胶质瘤;4级通常为GBM(胶质母细胞瘤),具有内皮细胞增殖或肿瘤坏死。一般来说,1-2级胶质瘤为低级别胶质瘤LGG,3-4级胶质瘤为高级别胶质瘤HGG,不同级别的胶质瘤治疗方式有所不同,预后和生存情况也大不同。
良、恶性胶质瘤预后差异
·一级胶质瘤如毛细胞星形细胞瘤手术全切后可达到长期的生存,甚至治愈标准,中位生存期长达50年
·二级胶质瘤如少突胶质瘤细胞瘤5年生存率为40-80%,中位生存期3-5年
·三级胶质瘤如星形细胞瘤、间变星形细胞瘤等5年生存率为30-60%,中位生存期2-4级
·四级胶质瘤如胶质母细胞瘤5年生存率小于10%,中位生存期14.6个月(注:不同的研究,结果可能会有轻微浮动)
良、恶胶质瘤不同组织代谢特征

良、恶性胶质瘤病理诊断差异
手术活检病理是胶质瘤确诊的金标准,病理学诊断也从H&E染色发展到电镜到免疫组化染色的方式转变。根据显微镜下脑肿瘤的异常外观,病理医师会基于胶质瘤的恶性或致癌程度对肿瘤进行1到4个级别的划分。一个肿瘤或许含有不同分级的细胞,但是医务人员会以恶化级别的细胞为分类基准。
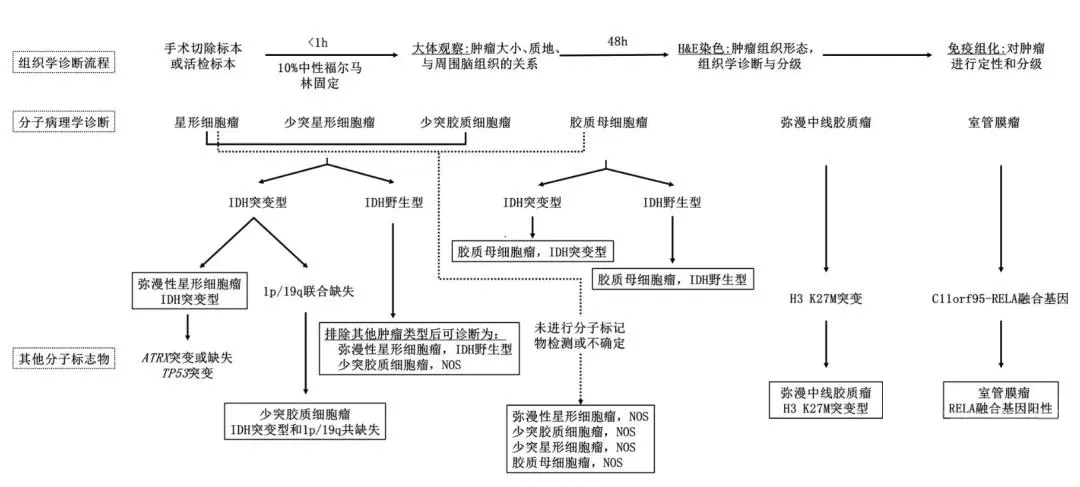
胶质瘤病理诊断流程图
肿瘤分级的意义在于标记肿瘤可能增长的速度以及肿瘤在脑内扩散的可能性,脑肿瘤的分级和分类由世界卫生组织(WHO)制定。被划分为1级和2级(grades 1 and 2)的神经胶质瘤被定义为低级别,因为它们的细胞分化良好,展现出的侵袭倾向较低,且有更好的预后。被划分为3级和4级的神经胶质瘤则被定义为高级别:它们的细胞未分化,且高度恶化,预后较差。
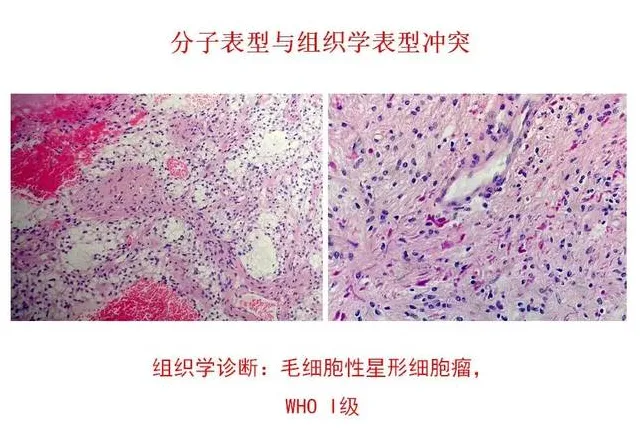
毛细胞性星形细胞瘤组织学形态
1级肿瘤往往与长期的生存期有关,1级脑肿瘤在儿童中很常见。在显微镜的观察下,1级脑肿瘤生长缓慢,其外观近乎正常。在手术后,1级肿瘤往往无需额外的治疗。1级肿瘤的一个例子就是毛细胞型星形细胞瘤。
室管膜下巨细胞星形细胞瘤组织学形态
2级肿瘤的生长相对缓慢。其中一些2级肿瘤可以扩散到邻近的正常组织中,亦可转化为一个分级更高的肿瘤。在手术后,2级肿瘤或许需要额外的治疗,也可能不需要。2级肿瘤的例证之一就是星形细胞瘤。
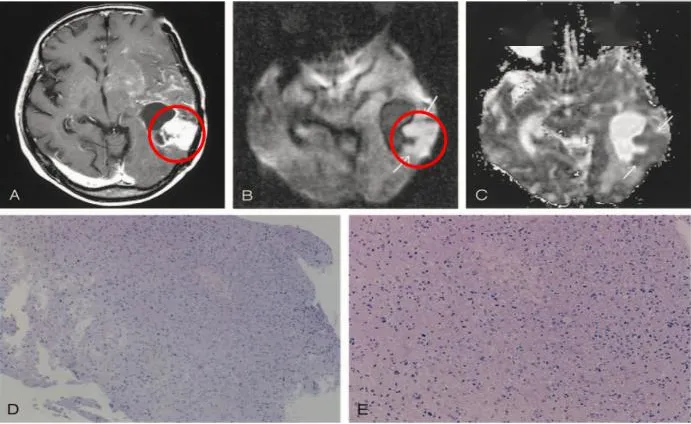
一例间变型星形细胞瘤放化疗后dwi影像及病理改变
从定义上看,3级肿瘤是恶性的,因为它们积极地繁殖侵袭周围组织的异常细胞。它们可以3级或4级的形式存在,具有循环往复的倾向。在手术后,3级和4级肿瘤往往需要外的治疗,特别是放射疗法和化学疗法的介入。3级肿瘤的一个代表是间变型星形细胞瘤。
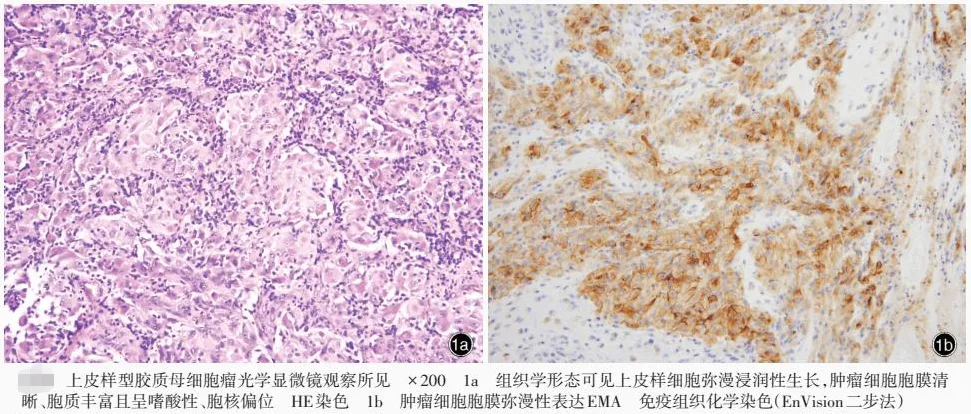
胶质母细胞瘤组织学形态
4级肿瘤是恶性程度高且具侵袭性的脑肿瘤。在显微镜观察下,它们的细胞极其异常。它们会征集新的血管以维持自身快速的生长。胶质母细胞瘤是常见的4级脑肿瘤。
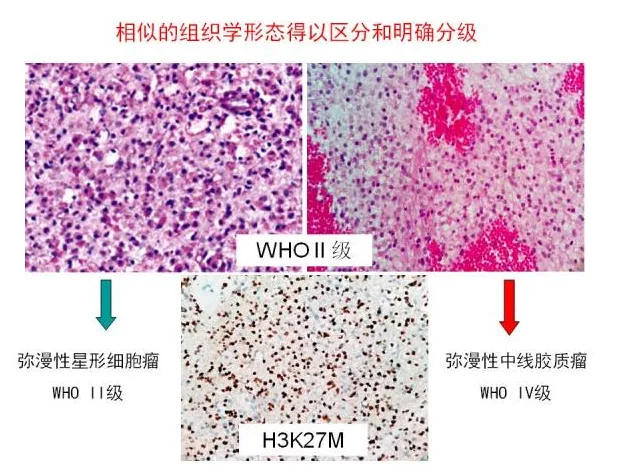
同时应该注意,有不少不典型胶质瘤,不同医院或病理医生会有不同意见,或者病理切片上具有”迷惑“性,此时,如果有患者对病理有疑问,可以申请再次病理切片会诊或者其他医院再次诊断。
近年来,神经肿瘤分子病理取得了重大进展,目前已发现一系列有助于脑胶质瘤临床诊断和预后判断的分子标志物。目前的WHO病理分级仍然依赖形态学进行肿瘤分级,然而,有充分的证据表明,组织特征相同或相似的胶质瘤可以具有不同的分子遗传学背景,导致WHO分级相同的个体间预后有着较大差异。基于肿瘤遗传学水平的分子病理分型能够更准确地判断临床预后;并且对组织学上较难鉴别的混合性胶质瘤(少突星形细胞瘤和间变性少突星形细胞瘤)还能帮助明确诊断和分级。另外,这些新近发现的分子变异有可能成为未来治疗的新靶点。
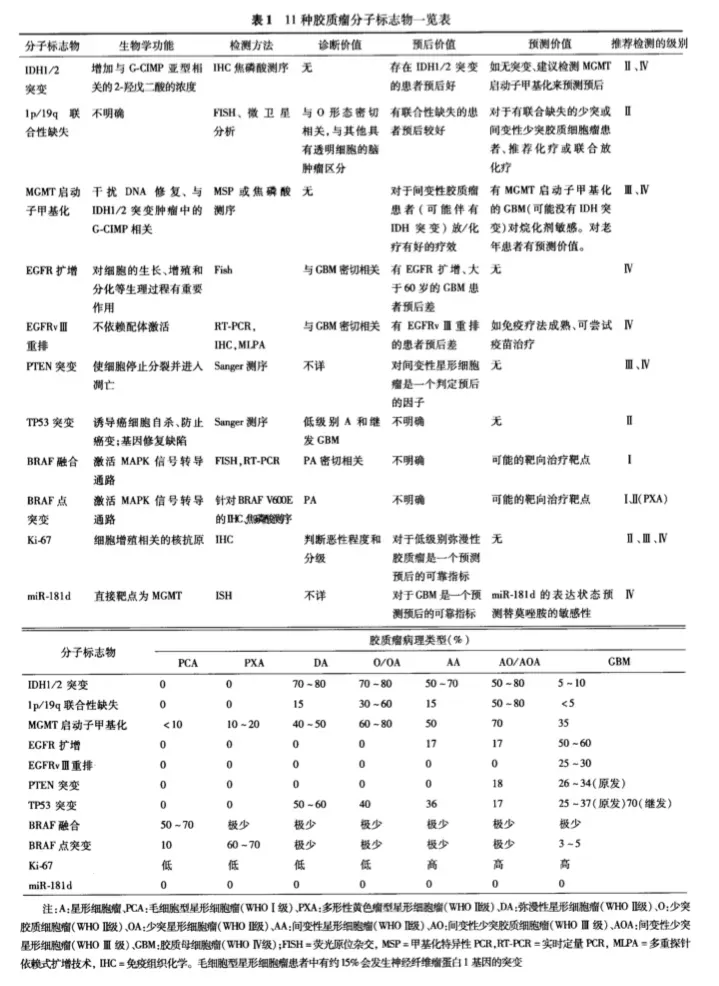
11种胶质瘤分子标记物一览
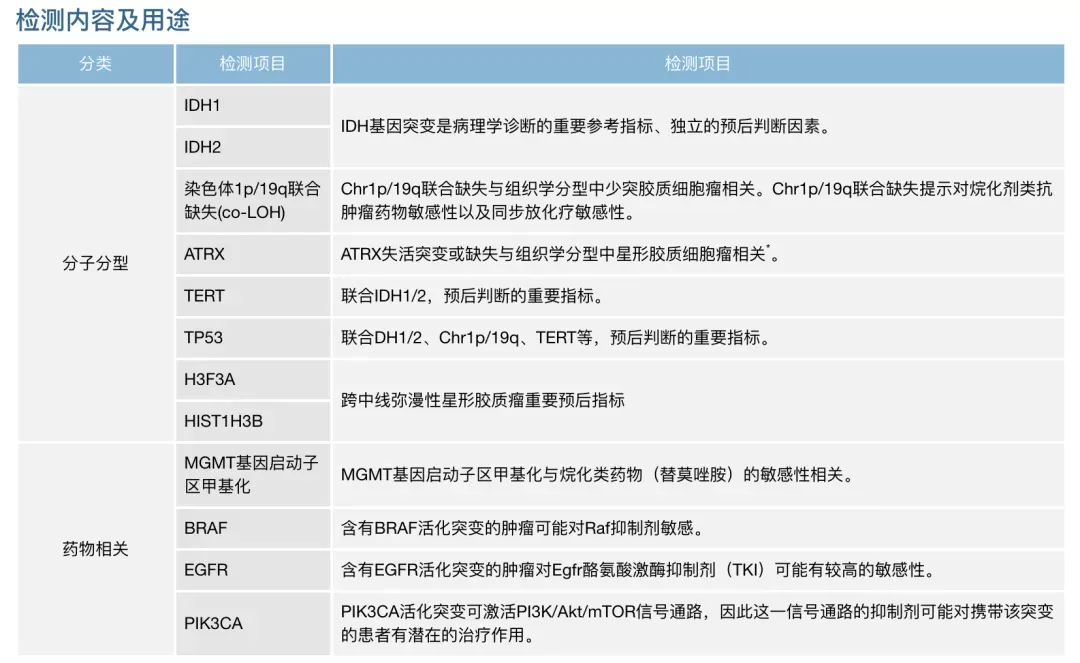
胶质瘤常用检测分子及意义总结
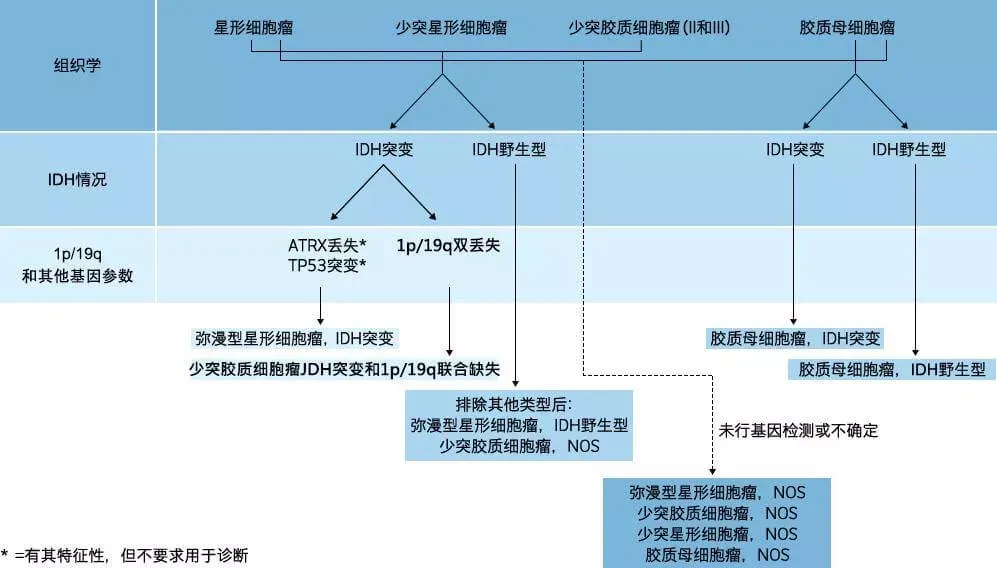
胶质瘤分子基因诊断图示
近10年来,脑胶质瘤的基础和临床研究有了较大突破,进一步了解胶质瘤的分子生物学特征,通过l期临床试验明确更多潜在的分子标志物,有望揭开脑胶质瘤病理生理和发病机制的神秘面纱。除了种族、性别、年龄、生活习惯等临床常见因素,重要的分子标志物的筛选,对临床胶质瘤进一步病理分型的诊断、治疗及预后判断等均有深远的意义。
良、恶性胶质瘤影像差别
1、直接征象:观察病变的特点,包括病灶的形态、信号特点及边缘情况,肿瘤内有无囊变、坏死、出血、钙化等,这些征象是确定肿瘤类型和良、恶性程度的重要依据。
2、强化表现:增强扫描反映的是血脑屏障是否存在或完整,病变的强化程度与血供及血脑屏障密切相关。低级别胶质瘤血脑屏障功能接近正常(不强化),高级别胶质瘤血脑屏障功能缺乏(强化、肿瘤破坏血管导致血脑屏障形成异常以及肿瘤新生血管),大多数胶质瘤的恶性程度越高,其血脑屏障受损越重,强化就越明显。
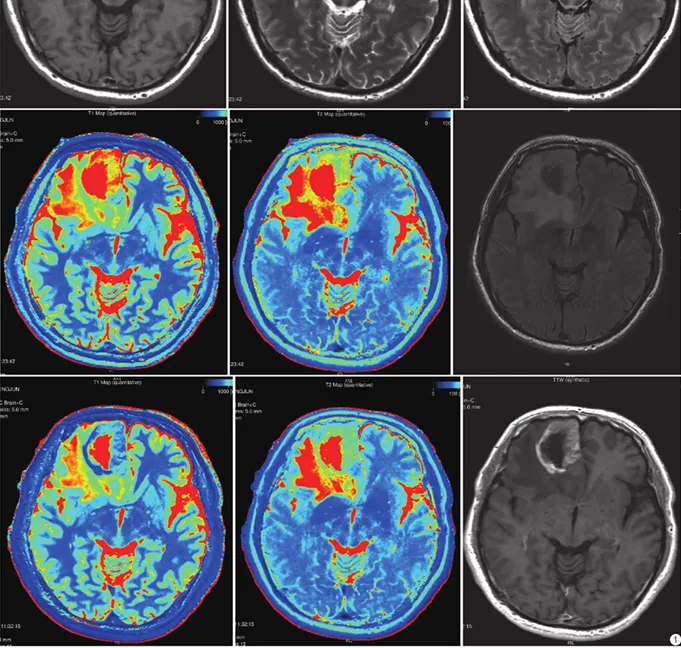
高级别胶质瘤。从左至右、从上到下分别是:合成图像(T1WI、T2WI、T2 FLAIR);合成T1 mapping、合成T2 mapping、常规扫描T2 FLAIR;增强后合成图像(T1 mapping+C、T2 mapping+C、T1WI+C)
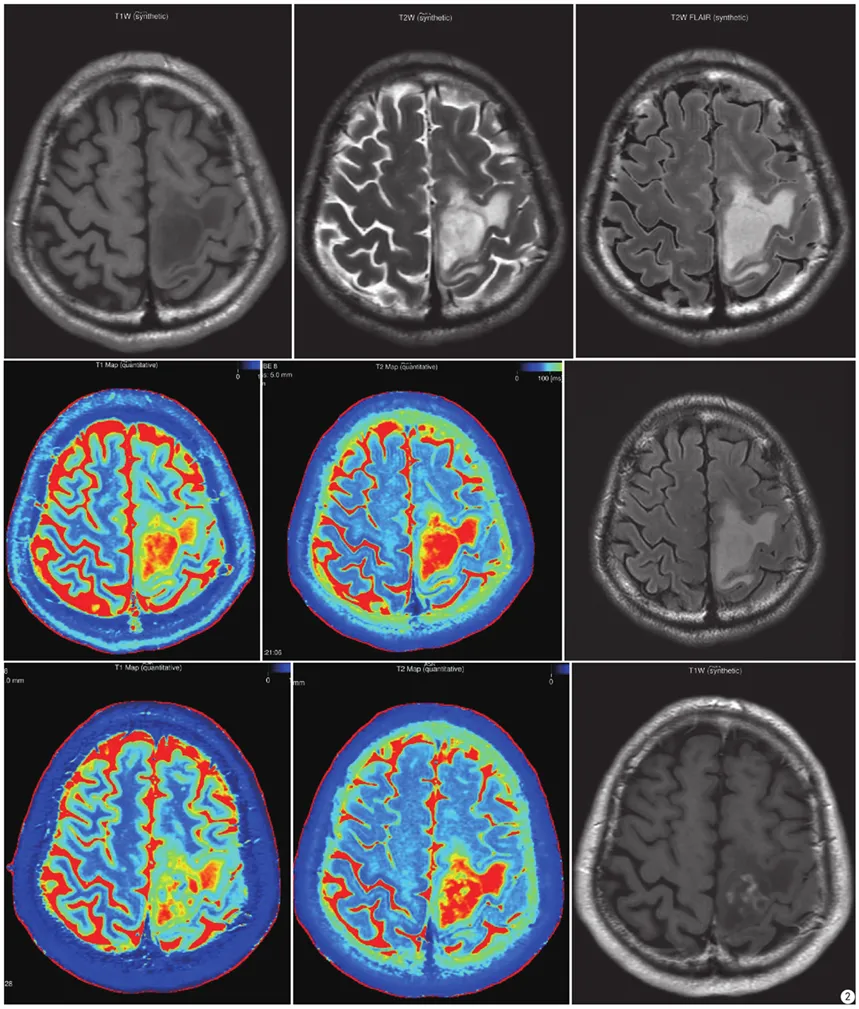
低级别胶质瘤。从左至右、从上到下分别是:合成图像(T1WI、T2WI、T2FLAIR);合成T1 mapping、合成T2 mapping、常规扫描T2 FLAIR;增强后合成图像(T1 mapping+C、T2 mapping+C、T1WI+C)
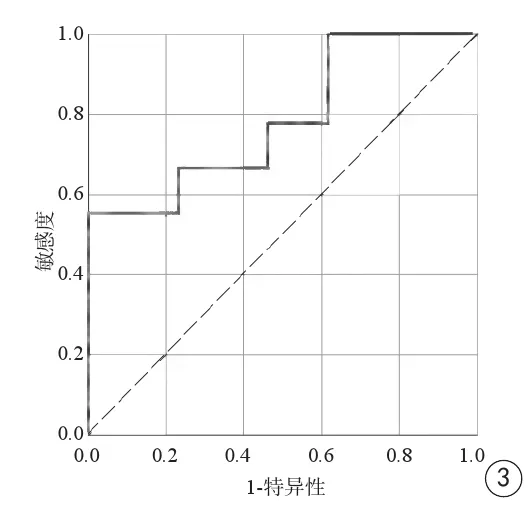
高级别胶质瘤与低级别胶质瘤增强后qT1的ROC曲线
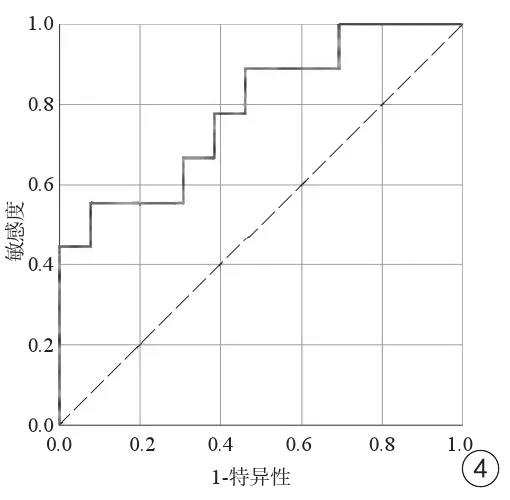
高级别胶质瘤与低级别胶质瘤增强后T1值变化的百分比的ROC曲线
良、恶性胶质瘤治疗原则
不论肿瘤良性恶性,确诊之后不要惊慌失措,积极就诊和治疗,手术是绝大多数脑胶质瘤的治疗方式。⼿术的⽬的有两个:在保留神经功能的前提下尽可能多的切除肿瘤;获得准确的肿瘤病理诊断分级。除了⼀些I级的肿瘤,胶质瘤并不能通过⼿术治愈。另⼀⽅⾯,借助良好的显微技术是可以很⼤限度的切除肿瘤,⽽不会造成周围正常脑组织的损害。
▼美国NCCN中枢神经系统癌症治疗指南节选
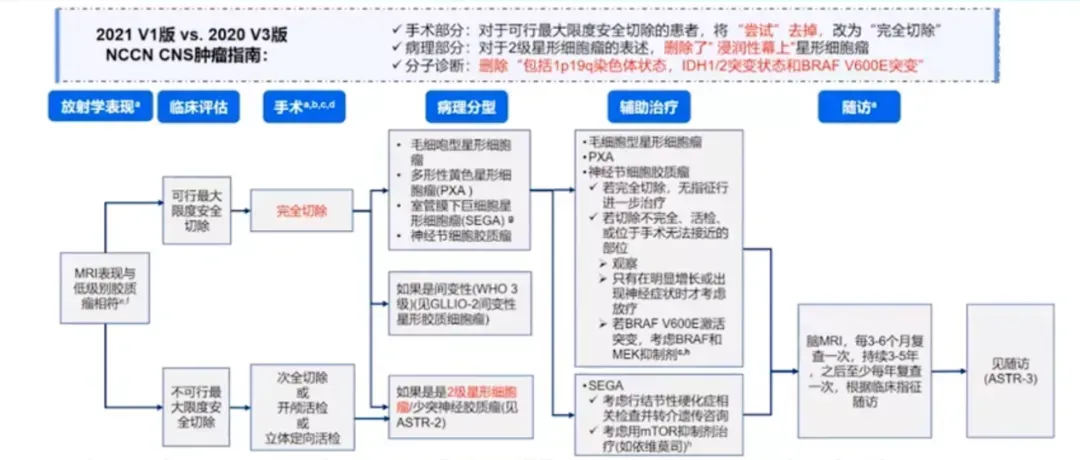
▼EANO欧洲神经肿瘤学会局限性星形胶质细胞瘤、胶质神经元和神经元肿瘤的指南(2022)

指南指出在可行的情况下,全切是延长生存期和实现长期癫痫控制的最重要的治疗方法。3级和未完全切除的2级肿瘤应考虑适形放疗。在复发肿瘤中,再次手术和放疗(包括立体定向放疗)可能是有用的。
▼2022年版脑胶质瘤诊疗指南

对于低级别的良性胶质瘤,手术全切带来的好处会更多,⽣存期也会更长⼀些。有些WHO 1级的胶质瘤可以通过全切治好。低级别的放化疗目前仍有争议,需要根据不同危险因素采取不同的治疗策略方案。
对于高级别的恶性胶质瘤,一般治疗原则为术中尽可能多的切除强化的病灶,当然如果可以不损伤神经全切那自是更佳,术后⾏放疗或化疗。⼿术本⾝的⽬的是切除肿瘤,但同时要减少神经系统并发症的发⽣,因为术后神经功能障碍可能缩短患者的⽣存期。
外科医生需要熟悉中枢神经系统的解剖、生理功能特点,进而选择针对患者的理想手术入路,并能对病变进行有效处理。此外,术前手术设计和术中操作应尽可能地保护重要结构不受损害,术中操作必须谨慎、细致,可借助术中磁共振(iMRI)、术中神经导航以及术中神经电生理监测等高科技设备,尽可能地保护正常的神经组织。对于胶质瘤患者,尤其是像脑干这种复杂位置的胶质瘤患者应选择具有疑难位置成功手术全切经验的主刀医生、完善的手术团队以及具备一些高科技术中神经外科手术设备的医院进行。
良性胶质瘤可恶化升级为恶性
这是一位40多岁女性,偶然诊断出低级别胶质瘤,医生建议保守观察,此时肿瘤仅3cm³。然而,肿瘤一直不断增长,6年后,肿瘤以肉眼可见的速度进一步增大,很麻烦了,已经11cm³……更让人想不到的是这个肿瘤从11cm³发展到21cm³,仅仅用了5个月!很遗憾,肿瘤不仅长大,术后的病理显示甚至已经恶化成,中位生存期仅14.6个月的4级胶质母细胞瘤。
▼肿瘤发展进程变化图片
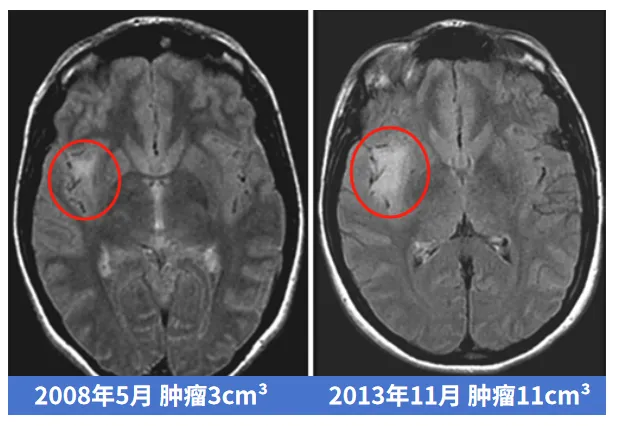
该则案例来源于INC国际Rutka教授主编的知名神经外科期刊JNS真实案例,原本预后较佳的低级别胶质瘤,错过了最佳手术时期,最终竟恶化成级别最高的胶质母细胞瘤,患者后悔不已,这时就算再手术,也不能明显延长生存期。
▼论文截图:偶然发现的无症状2级胶质瘤患者没有治疗急性进展为胶质母细胞瘤
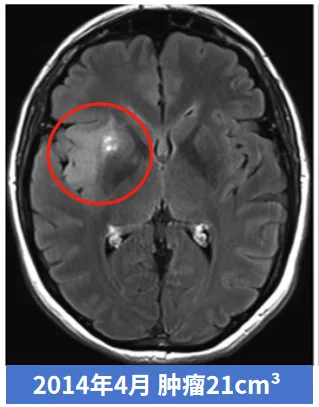
本病例显示,无症状低级别胶质瘤的进展也不一定都是匀速的,也可能不经过WHO 3级胶质瘤的过度,就急性发展为胶质母细胞瘤。
胶质瘤包括很多脑肿瘤的脑肿瘤治疗实际上是个与时间赛跑的过程,脑肿瘤会在快速或缓慢进展,其恶化或转移所给患者带来的都可能就是无法承受的严重后果。早期手术是脑肿瘤有效治疗的好时机。如果病情发展到中晚期,有限的治疗时机都可能被白白浪费!
参考文献:
胶质瘤诊疗指南.2022版




