丘脑胶质瘤(thalamic gliomas)是一组主要起源于背侧丘脑并可侵袭脑干、内囊、基底节区等重要功能区的脑胶质瘤总称。丘脑胶质瘤约占全部颅内肿瘤的1%~5%,其中多数为星形细胞胶质瘤,丘脑胶质瘤的发病年龄呈现双峰分布的特点,好发于儿童/青少年及40岁以上的成人。
1932年,在一届Harvey Cushing Society[现为美国神经外科医师协会(American association of neurosurgeons,AANS)]上一次报道了为1例年轻女性丘脑肿瘤患者成功实施了手术治疗,患者术后恢复迅速且存活时间长达13年。此后近半个世纪,关于手术治疗丘脑肿瘤的报道不断出现,探讨手术切除对丘脑肿瘤的可行性和顺利性。由于丘脑位置深在、周围毗邻重要脑组织和血管结构,以及肿瘤浸润等特征,手术难度较大,手术全切率较低,术后并发症发生率及死亡率较高,且预后较差,总体预后并不尽人意;故治疗上主要以活检和术后辅助治疗为主。自20世纪80年代之后,随着CT和MRI的临床应用和普及,以及显微镜等新型手术辅助技术的应用,微侵袭神经外科理念得以提出并快速发展,丘脑胶质瘤的手术切除程度大幅提高(>90%切除率:39%~99%);同时围手术期病死率和致残率明显下降(病死率:约5%)。近些年来,国内外多个神经外科中心总结报道了手术治疗丘脑胶质瘤的临床结果,显示顺利范围内较大化切除肿瘤有益于延长丘脑胶质瘤患者的总生存期(overall survival,OS),主张对丘脑胶质瘤患者实施手术治疗(多个一致性Ⅲ级证据)。
目前,丘脑胶质瘤的治疗方法主要有手术切除结合术后放化疗的综合治疗,立体定向活检结合放化疗及随访观察等。截至目前,丘脑胶质瘤的外科治疗尚无相关咨询规范,也缺乏统一的外科管理策略。为此,中国医师协会脑胶质瘤委员会、中国抗癌协会脑胶质瘤委员会和中国脑胶质瘤协作组共同组织脑胶质瘤领域相关专家和学者撰写《成人丘脑胶质瘤手术治疗中国专家共识》。因成人与儿童丘脑胶质瘤在临床表现、分子病理、手术治疗效果存在着差异,本共识仅对手术治疗成人丘脑胶质瘤进行详述。
背侧丘脑及其周围结构的解剖学特点
丘脑在形态上可见其被“Y”形白质板将丘脑分为前核群、内侧核群和外侧核群3部分。其中外侧核群又可分为背、腹两侧:腹侧组由前向后分为腹前核、腹中间核和腹后核,腹后核又分为腹后内侧核和腹后外侧核。其中丘脑前核群与机体内脏活动调节相关;内侧核群发出投射纤维与苍白球、前额叶皮质、额叶眶面后外嗅区广泛联系,对嗅觉刺激产生反应。背侧核团向后逐步延续为丘脑枕,与扣带回、海马回、海马旁回及顶叶皮质相互联系。腹侧核则是躯体感觉传导的主要中继站。
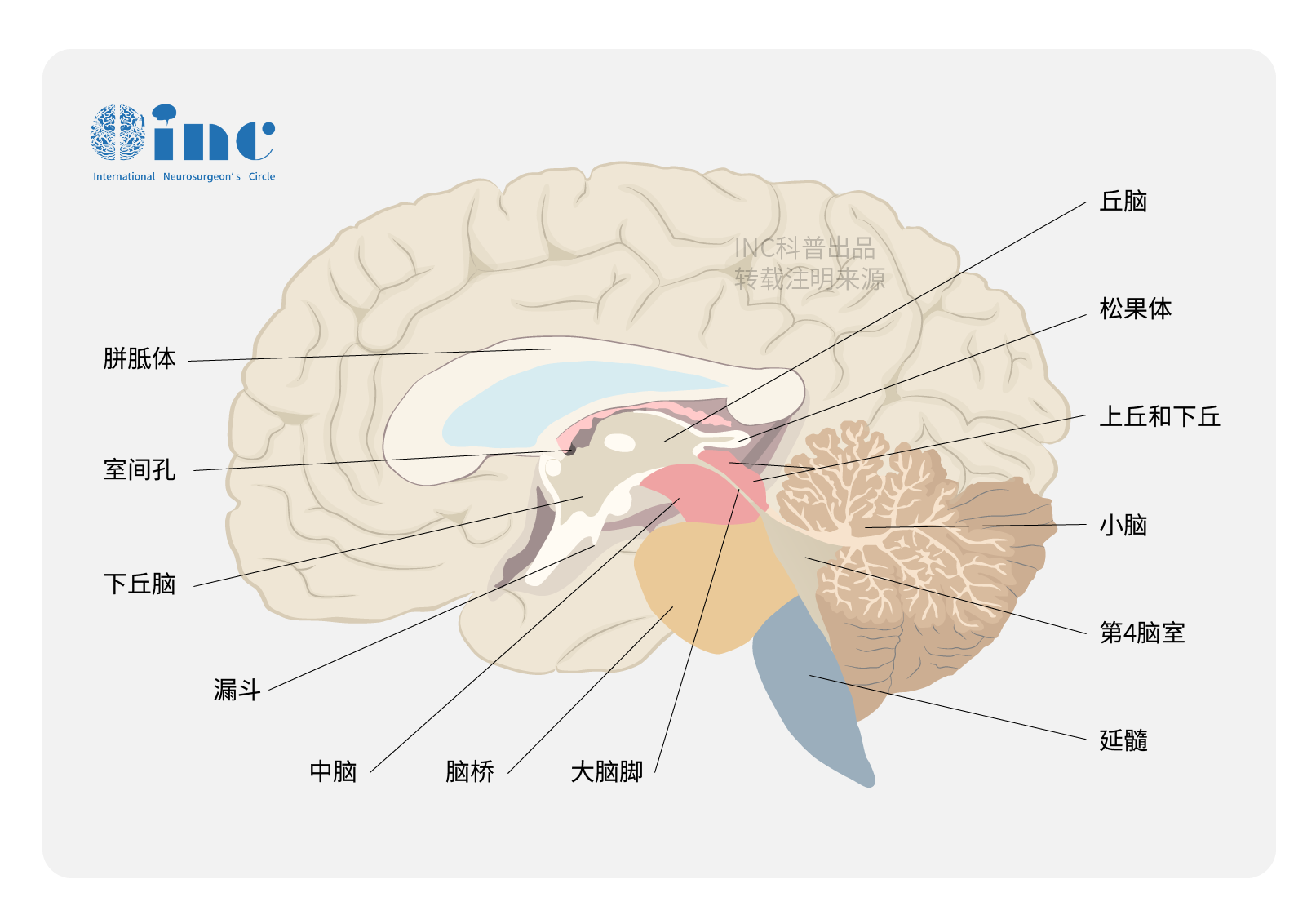
丘脑同时接受来自椎-基底动脉系统及颈内动脉系统的血液供应,丘脑的供血动脉大部分来自椎-基底动脉系统,较为重要的有旁中央动脉/丘脑穿动脉、下外侧动脉/丘脑膝状体动脉及脉络膜后动脉丘脑支等;其中,丘脑内侧核群主要由丘脑穿动脉和脉络膜后动脉丘脑支等供应,丘脑膝状体动脉主要供应腹后核群及内侧膝状体。来源于颈内动脉系统发出多个穿支血管供应丘脑,但不是丘脑主要供血动脉;其中较重要的为来自后交通动脉的丘脑结节动脉,负责供应乳头体及丘脑束。这些供血动脉和其发出的穿支血管在丘脑底面从两侧和前后方包绕丘脑,因此丘脑顶是相对无动脉血管区域。大脑深静脉系统如丘脑纹状体静脉和丘脑外侧静脉引流丘脑血供。这些静脉流入大脑内静脉和Rosenthal基底静脉,随后汇入Galen静脉。在室间孔附件烧闭丘脑纹状体静脉或其他静脉可能会导致嗜睡、偏瘫、缄默和基底节区出血性梗死。
丘脑位于大脑半球深部,其前下方则毗邻下丘脑及中脑,约50%的丘脑表面被内囊所覆盖。丘脑周围包括四个重要的游离间隙(free surface),Yasargil将丘脑的四个游离面分为侧脑室面、脉络膜面、三脑室面及四叠体池面,每一个游离面都能通过经侧脑室入路或经四叠体池入路达到。这样的不同毗邻关系使丘脑手术入路的选择重要。充分了解背侧丘脑及其周围结构的解剖可以使术者从容地根据肿瘤生长方式选择经皮层入路或利用丘脑的游离间隙入路切除病变。
丘脑胶质瘤的临床表现
丘脑胶质瘤临床症状复杂,主要表现为丘脑周围结构受损引起的对侧躯体感觉、运动、视力障碍、高级认知神经功能下降等症状;以及肿瘤占位效应引起的高颅压症和幕上脑室系统积水及伴随症状等,包括头痛、恶心、呕吐、视力模糊、大小便失禁、步态站立不稳等,可伴有偶伴复视、眩晕及癫痫发作;双侧丘脑胶质瘤可以引起行为、记忆障碍等,并可出现精神症状。
丘脑胶质瘤的手术时机
早期对于丘脑胶质瘤的治疗选择包括立体定向活检或保守观察,随着神经外科手术技术的进步,目前更多的研究认为以手术切除肿瘤为主并联合放化疗的治疗方法能够延长丘脑胶质瘤患者的生存时间,好转患者的临床症状。
关于手术时机,原则上对于影像学诊断为丘脑胶质瘤并且有临床症状的患者,应尽早手术治疗。而偶然发现或无临床症状的丘脑病变患者,若病变直径较小,应在充分与患者及家属沟通病情的前提下,可每3个月进行影像学观察肿瘤变化或者行立体定向活检,当发现肿瘤体积增大或临床病情进展时则应行手术治疗。
手术适应证和禁忌证
适应证主要包括经影像学诊断高度怀疑丘脑胶质瘤;经影像学诊断怀疑丘脑胶质瘤,虽无明显临床症状,但在观察期间出现恶性演变倾向征象,如肿瘤增大或者出现明显强化病变;经影像学诊断性质不明的丘脑病变且伴有明显临床症状的患者。经影像学诊断性质不明的丘脑病变,无临床症状的患者,可选择活检或观察。
禁忌证主要包括严重多脏器功能衰竭不能耐受手术的患者;Karnofsky功能状态评分(Karnofsky performance status scale,KPS)<50分;具有其他不适合接受神经外科手术的禁忌证,如严重凝血功能障碍等。
手术切除策略与手术辅助技术
手术切除策略
在处理丘脑胶质瘤时需要明确三大主要目的:即肿瘤性质确定、肿瘤切除及脑脊液通道的重建。对于丘脑胶质瘤,手术切除策略应以顺利范围内的较大化切除为基本原则。对于单侧成人丘脑胶质瘤,尽可能地全切肿瘤,能够延长总生存期(多个一致性Ⅲ级/Ⅳ级证据)。对于双侧丘脑胶质瘤,部分性切除相对于活检能够延长总生存期(Ⅳ级证据)。具体手术策略包括切除术与活检术,其中切除术又包括肿瘤全切除、次全切除和部分切除:(1)肿瘤全切除,适用于肿瘤主体由丘脑起源并凸向内侧三脑室或侧脑室三角区的病变;(2)顺利范围内的较大化切除,适用于弥漫型生长的丘脑胶质瘤或双侧丘脑胶质瘤;(3)以诊断为目的部分切除/活检,适用于弥漫型丘脑胶质瘤且无法耐受开颅手术的患者。
丘脑位于大脑半球深部,根据丘脑胶质瘤肿瘤主体的生长方向,可将丘脑胶质瘤的手术入路分为前方入路、侧方入路及后方入路,几乎全部丘脑病变都可以通过前方入路或后方入路的途径从四个游离丘脑间隙(侧脑室面、脉络膜面、三脑室面及四叠体池面)之一进入,并且可以在术中暴露一个或者多个丘脑的游离间隙。本共识综合建议术者根据肿瘤主体生长方向,在神经纤维束导航和术中神经电生理监测的引导下,特别强调应该结合术者的经验个体化来选择丘脑胶质瘤的手术策略及手术入路。以较近的距离,做到较大的暴露和较小的损伤。本共识将结合丘脑胶质瘤的生长方式对手术入路的选择阐述如下(表2)。
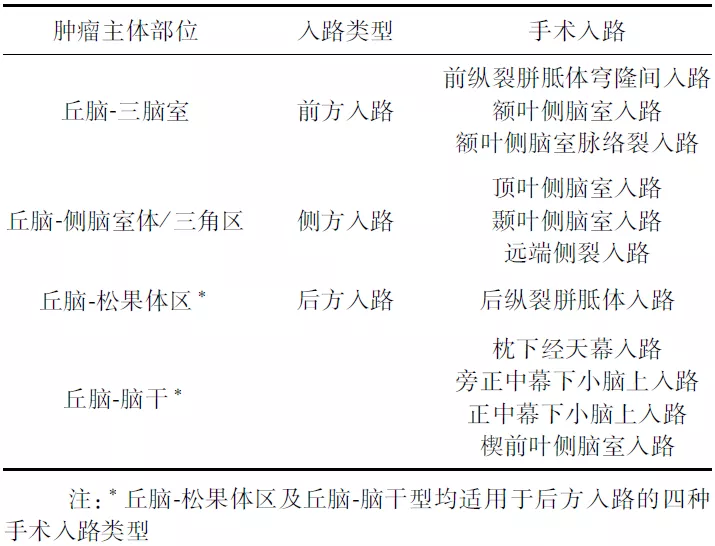
表2丘脑胶质瘤的发生部位与手术入路选择
前方入路适用于肿瘤主体凸向内侧并伴有梗阻性脑积水的患者。该入路可以充分利用大脑自然间隙(纵裂、透明隔间隙、脉络裂)进行手术操作。该手术入路的优势在于无需切开皮质,术中对丘纹静脉、大脑内静脉等重要解剖结构显露清晰,并可直视下进行三脑室底造瘘,缺点在于胼胝体切开可能带来缄默、记忆障碍等并发症。非优势半球肿瘤的患者同样可以选择经额叶皮质-侧脑室-脉络裂/穹隆间入路。术前伴有梗阻性脑积水的患者可经前方入路。
侧方入路适用于突入侧脑室或基底节区的丘脑肿瘤。可以选择经顶叶侧脑室入路或颞叶侧脑室入路。经皮质入路操作相对简单,便于暴露肿瘤,对重要的回流静脉影响较小。缺点是颅内压力较高时对皮质和皮质下纤维牵拉作用较大,并且容易出现下丘脑结构失认导致下丘脑损伤。
后方入路适用于丘脑后份,突入四叠体池,或者超出胼胝体压部的丘脑肿瘤。该入路循自然间隙,可不切开正常脑组织抵达肿瘤。在内镜辅助下操作,充分利用双镜联合的方式,优势更明显。缺点在于Galen静脉、大脑内静脉、枕内静脉、基底静脉等可能会影响手术操作。同时需要小心避免损伤到后内侧脉络膜动脉。
丘脑胶质瘤毗邻三脑室和侧脑室,易导致梗阻性脑积水,术前脑积水的发生率约在18.5%~51%左右。术后脑积水的发生率各研究中心报道不一,约在10.8%~12.1%之间;发生的原因主要是丘脑胶质瘤切除术后脑组织顺应发生了改变,如术后侧脑室塌陷,导致颞角分离,或脑间孔堵塞,较终导致脑脊液导管闭塞,或者是由于切除高级别胶质瘤可能会改变脑脊液蛋白质含量并导致交通性脑积水的发生。丘脑胶质瘤手术的重要目的之一是重建脑脊液循环,好转术前脑积水及避免术后的脑积水的发生。在切除肿瘤后,尽可能进行三脑室底造瘘(前方入路)或打通四叠体池(后方入路),从而重建脑脊液循环通路;手术完成后完全止血,且尽可能在脑室系统中避免使用止血材料,术后使用大量生理盐水冲洗创腔,尽较大可能避免阻塞中脑导水管。
手术辅助技术
通过综合运用神经导航、术前/术中MRI、术中超声、神经电生理监测、神经内镜、实时荧光染色等辅助技术有助于实现丘脑胶质瘤顺利范围内的较大化切除。
神经导航将术前得到的MRI T1WI结构数据、神经纤维束重建数据、肿瘤三维信息融合进入神经导航系统,在神经导航辅助下确认病变的体表投影,合理设计切口与手术入路。术中可以根据光学导航探针确定纤维束的位置及手术切除深度,有助于保护神经功能(多个一致性Ⅲ级证据)。其缺点是神经导航定位信息容易受到脑组织漂移的影响。
术前/术中MRI术前功能MRI可以获取重要脑功能区的定位信息,手术中MRI可以获取脑组织移位的数据信息,更新导航信息。合理结合术中MRI技术可以提高脑胶质瘤的切除术程度,准确判断是否全切(多个一致性Ⅱ级证据及Ⅲ级证据)。丘脑胶质瘤病例使用术中MRI技术协助切除丘脑胶质瘤。
术中超声相对于术中MRI技术,术中超声辅助具有普及性强、操作简单,对于病灶实时显影等特点。对术中肿瘤定位、判断肿瘤切除程度、内部血流情况有帮助。超声造影可以显示肿瘤血供情况,可帮助进一步识别肿瘤边界,增加肿瘤切除程度并延长患者总生存期(多个一致性Ⅲ级证据)。
神经电生理监测对于手术入路未暴露中央前回皮层,无法采用直接皮层电刺激技术(direct cortical stimulation,DCS)评估直接运动传导通路完整性的患者,可采用体感诱发电位(sensory evoked potentials,SEP)、经颅运动诱发电位(transcranial motor evoked potentials,TcMEP)和皮层下直接电刺激(subcortical stimulation,SCS)的多模式监测技术。其中SEP可监测人体重要上行感觉传导通路,包括延髓薄束、楔束核发出的上行纤维至背侧丘脑的腹后外侧核换元,其轴突上行至内囊后肢,经丘脑皮质束呈扇形辐射至中央后回初级感觉皮层;同时SEP还可以监测颈内动脉、大脑中动脉供血区域的缺血性损伤。SCS技术采用单较高频刺激法,根据刺激电量1 mA约等于1 mm的公式可在深部皮层下电刺激精确定位与皮质脊髓束(corticospinal tract,CST)的距离。在丘脑胶质瘤中使用TcMEP技术可评估直接运动传导通路完整性,但由于刺激电量与刺激深度相关,需要在监测肌松状态下采用阈刺激并观察记录刺激阈值的变化。同时TcMEP技术还可以监测供应内囊、丘脑的深部穿支血管的缺血性损伤。同时使用经颅MEP技术、皮层电刺激及皮质下电刺激监测技术有助于提高监测的准确性。其中经皮层电刺激/经颅MEP技术能够确认整个皮质脊髓束功能的完整性,皮层电刺激相对于经颅MEP技术准确度更高,皮质下电刺激技术通过判断刺激电流的大小对于CST的相对位置能够精确定位(Ⅱ级证据,多个一致性Ⅲ级证据)。
神经内镜技术可使用神经内镜辅助在开始切除丘脑胶质瘤前进行探查,结合内镜抵近观察和侧视观察的优势,在双镜联合的情况下了解丘脑胶质瘤病变范围及周围重要毗邻解剖,在肿瘤切除结束时再次探测手术区域,检查显微镜视野盲区周围是否有肿瘤残余及出血,并进一步确保导水管通畅(Ⅳ级证据)(显微镜联合/后入路)。
实时荧光显像技术使用以实时荧光为引导的胶质瘤切除手术,能够协助判断胶质瘤边界及切除范围,提高胶质瘤全切率,延长患者无症状生存期及总生存期(多个一致性Ⅲ级证据)。使用荧光素纳与5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA)对肿瘤切除程度、患者总生存期的影响无统计学差异(Ⅲ级证据)。
丘脑胶质瘤术后复发的处理
丘脑胶质瘤的复发可表现为原位复发、远处复发以及脊髓播散,建议多学科咨询讨论决定治疗方案。丘脑胶质瘤术后复发的治疗策略包括再手术,再放疗,化疗药物治疗,电场治疗等。对于一般情况良好、肿瘤呈局限性病灶复发的患者,可考虑再次手术。对于丘脑胶质瘤(WHOⅡ-Ⅳ级)放化疗后出现假性进展或放射性坏死,可给予甘露醇脱水、糖皮质激素冲击治疗或联合贝伐单抗药物降低颅内水肿。如患者保守治疗后颅内压仍进一步增高,颅内水肿进行性加重,可选择再次开颅手术切除病变。
预后及随访
成人丘脑胶质瘤,相比幕上胶质瘤,由于不同的中线部位解剖位置,弥漫性的生长方式,以及相对不同的病理分子特征,通常总体预后较差。国内外多个单中心病例分析报道显示,成人丘脑胶质瘤的中位总生存期仅为11.5~17个月,1年生存率为48%~68.1%,2年生存率为20%~25.9%。
多项临床研究显示,丘脑胶质瘤患者的总生存期与多种预后因素相关,包括一般临床特征、影像学特征、治疗方式以及分子病理特征等,如患者的症状、病程、术前KPS评分、语言症状、合并脑积水、手术切除程度、治疗模式、H3K27M突变等。一般而言,较短的病程(<1个月)、术前KPS评分<80分、术前语言障碍、术前运动功能障碍、术前合并脑积水、肿瘤未全切或次全切、高级别组织类型、H3K27M突变等是预后不良的相关因素;携带H3K27M突变的中线部位弥漫性胶质瘤整体预后较差,2年生存率不足10%。
丘脑胶质瘤患者的总体生存期较差,且术后常伴随程度的神经功能缺失症状,术后48 h内复查头部MRI评估手术切除程度,为下一步放化疗等辅助治疗提供基线参考数据。术后3个月内,建议每个月进行随访评估KPS评分,必要时复查头部CT/MRI评估是否存在脑积水或是否加重/缓解等。3个月后,建议每3个月(对无明显症状或症状逐渐好转者可延长至6个月)进行一次随访,评估方式采用神经影像学联合行为量表相结合,行头部MRI检查,进行生活质量和功能状态评估。期间如有新发癫痫症状或者原有神经功能缺失症状加重,应及时复查头部CT/MRI,明确是否存在肿瘤复发进展或存在脑积水等并发症。




