恶性胶质瘤是成人较常见的原发性脑瘤。它表现出对脑实质的广泛侵犯,从而逃避了目前常规化疗、放疗和手术的多模式治疗模式。尽管这种多模式治疗方案取得了较大的进展,但恶性胶质瘤患者的预后仍然不佳。症状出现后的平均生存时间为12-16个月,超过70%-80%的患者在2年内死亡。这种疾病的高度侵袭性和复杂的分子基础都说明了它对目前传统疗法的顽固。因此,分子靶向治疗对好转临床疗效至关重要。然而分子靶向治疗同样面临着如何突破血脑屏障的挑战。
血脑屏障——难以跨越的大脑堡垒
分子靶向治疗的一个主要挑战是血脑屏障(BBB)的转运,它在结构和生理上都阻碍了血脑屏障的转运。血脑屏障限制了许多传统化疗药物的合适性,使系统给药成为多数化疗药物的无效选择。例如,阿霉素是一种化疗药物,虽然不能明显越过血脑屏障,但在体外对恶性胶质瘤合适。考虑到控制血脑屏障递送的各种转运机制,分子靶向胶质瘤治疗也面临类似的递送挑战。
聚焦超声对血脑屏障的损害是一种有前途的新型非侵入性技术,它可以绕过血脑屏障的一些解剖学限制,从而增强治疗药物进入大脑的能力。低频超声波经颅传递,导致脑内局灶区血脑屏障的损害。鉴于局灶性和选择性给药的潜力以及增强治疗给药的固有优势,对此,INC国际神经外科医生集团旗下国际神经外科顾问团(WANG)成员,国际神经外科杂志《Journal of Neurosurgery》主编,加拿大多伦多大学儿童医院脑瘤研究中心主任James T. Rutka教授对此进行了长期深入的研究。在其论文《Focused ultrasound disruption of the blood-brain barrier: a new frontier for therapeutic delivery in molecular neurooncology》中深入探讨了FUS在分子神经肿瘤学中的潜在应用和意义。其实验室在研究脑肿瘤生长和侵袭的机制方面颇有成就,并在Sunnybrook健康科学中心和多伦多大学生物材料和生物医学工程研究所的合作下,正在设计一种基于纳米颗粒的输送系统,作为治疗胶质瘤的一种新方法。本文将详细介绍James T. Rutka教授的关于如何突破血脑屏障的研究成果。
传统的非聚焦BBB干扰策略——广泛的血脑屏障损害和潜在的有害后果
由于大多数治疗药物不容易越过血脑屏障,因此以前已经开始采用几种策略对血脑屏障进行暂时性损害。血脑屏障的短暂损害可以使用诸如甘露醇之类的渗透剂来实现,甘露醇是通过动脉内的颈动脉输送的。这种方法的可行性已在脑肿瘤中得到证实。此外,烷基化醇,如烷基甘油,在动脉内输送时以类似的方式打开血脑屏障。除了渗透剂外,还有受体介导的机制可以增强血脑屏障的通透性。一个的例子是缓激肽系统,类似于RMP-7已经被用于提高血脑屏障的通透性。然而,当类似的策略应用于儿童脑瘤和复发性胶质瘤的II期试验时,临床结果并不那么有希望。一个主要的陷阱是未能在大脑中获得合理的治疗浓度。
增强血脑屏障的通透性既有好处,也有坏处。虽然血脑屏障限制了药物进入大脑,但它也保护大脑免受全身毒素的侵害。使用甘露醇或缓激肽类似物等渗透剂的血脑屏障损害策略可导致广泛的血脑屏障损害和潜在的有害后果。
聚焦超声对血脑屏障的损害:原理
与其他传统的BBB干扰方案相比,FUS干扰BBB的一个独特优势是选择性和区域性通透性增加,从而增强了脑内的局部传递(表2)。该技术需要低频超声经颅传递,较终导致血脑屏障的损害(图1)。典型地,超声暴露在10 msec的压力幅值小于1 MPa的情况下持续20-30秒,频率为1 Hz.19,通过使用低频,长期性组织损伤的机会被较小化。这项技术可用于结合成像先生针对焦BBB损害的宗旨和文档,由区域对比清单外渗(图2)。将静脉注射lipid-encased全氟化碳气体微气泡直径(1 - 5毫米)进一步降低了频率为BBB损害阈值,从而允许更低和更顺利的使用频率。10年前,微泡辅助FUS对BBB进行损害的可行性一次得到成功论证。在没有微气泡的情况下,FUS BBB破碎效应不那么明显,因为声功率要低两个数量级。当微气泡通过毛细血管时,根据超声波输入,它们会膨胀和收缩。假设FUS通过毛细管壁引起微泡的振荡和浓度,进而施加机械力导致血脑屏障的打开。此外,微气泡发出的声信号在血管损伤不存在的情况下与BBB的损害高度相关,提示声信号可以作为顺利性的替代。FUS对脑血脑屏障的损害是顺利的,其总体影响是短暂的,可逆的,没有明显的神经损伤。随后的BBB中断较多持续约4小时。
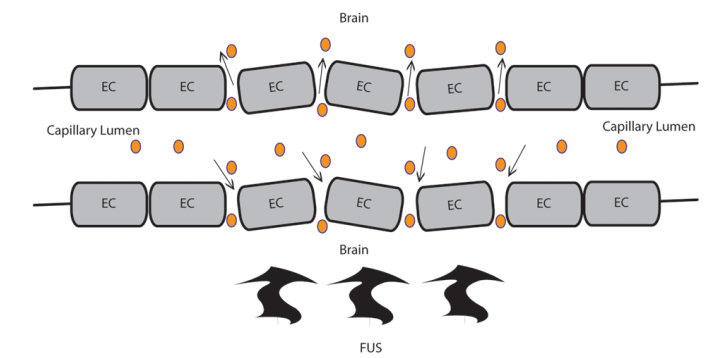
图1所示。在BBB被FUS损害后,BBB增强递送的示意图。聚焦超声传递低频超声波,引起微泡的机械振动,损害内皮细胞的紧密连接,增强血脑屏障对试剂的通透性。
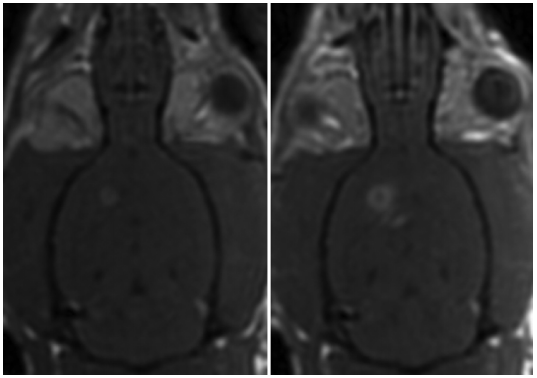
图2所示。磁共振成像引导下FUS损害脑肿瘤移植物周围的血脑屏障。冠状面钆增强t1加权磁共振图像的大鼠脑前(左)和后(右)超声。超声证实的右半球周围肿瘤超声增强增强。无回声的左半球缺乏对比度增强。
FUS突破血脑屏障的临床的四大应用
一,向大脑输送抗体
FUS较实用的治疗特性之一是将抗体输送到大脑的能力,这在之前的研究中得到了证明。研究人员通过FUS介导证实了多巴胺D受体靶向抗体与脑内随后的抗原识别的BBB交叉。传统上,抗体治疗的一个主要障碍是,由于缺乏大的水通道或抗体在脑血管内皮细胞中的主动转运机制,抗体通过血脑屏障的能力有限。然而,有几种神经障碍的抗体介导治疗将是有利的。例如,在阿尔茨海默病中,淀粉样b斑块的积累是毒性和认知障碍的基础。有趣的是,在转基因小鼠中,只以及正常动物中,只直接颅内注射抗淀粉样蛋白b抗体导致斑块大量减少。直接颅内注射的一个障碍是它的侵袭性。较近,使用MR成像引导FUS,静脉注射抗淀粉样b抗体到转基因小鼠体内,这导致治疗后4天斑块减少。研究人员还注意到,使用FUS时,更低剂量的抗体也能合适减少斑块。
另一个与抗体治疗相关的潜在领域是癌症靶向治疗。抗肿瘤单克隆抗体已被成功地用于治疗全身癌症,可能在脑转移性或原发性癌症方面具有潜在的应用价值。例如,Herceptin是一种抗her2单克隆抗体,是乳腺癌的治疗靶点,在MR成像引导下FUS作为概念验证成功地通过了BBB。这一概念证明是令人鼓舞的,鉴于其他抗肿瘤抗体的潜在外推。
二,常规化疗药物进入大脑
考虑到血脑屏障降低了常规化疗药物进入大脑的生物利用度,之前已经采用了几种策略。临床前的结果是有希望的,但只有较低限度的好处已记录在临床试验。增加化疗药物脑浓度的一种方法是使用可生物降解的基质。满载化疗药物的基质被植入肿瘤切除腔内。其他方法。然而,即使采用这些方法,由于化疗的生物利用度不足,其疗效仍不理想。
因此,我们对FUS进行了临床前研究,以评估化疗进入脑肿瘤的可行性。这一策略一次成功地使用了阿霉素,它并没有明显地跨越BBB.74。研究者们成功地证明了脂质体包裹的阿霉素在正常大鼠的大脑半球内的浓度与未处理的大鼠大脑半球相比有的增加。在随后的随访研究中,研究人员证实了在颅内神经胶质瘤大鼠中,通过fus介导的脂质体包封阿霉素的传递具有实质性的治疗作用。
到目前为止,临床前的数据显示,fus介导的化疗药物进入大脑是有希望的。初步结果表明了该方法的可行性和合适性。更多成功的临床前应用应该为临床研究铺平道路。
三,治疗性纳米颗粒进入大脑
基于纳米技术的递送系统已经引起了人们对肿瘤靶向应用的较大兴趣。28通过这些独特的特性,纳米颗粒传递平台可以潜在地规避一些与恶性脑瘤传统化疗相关的挑战。然而,BBB仍然是纳米平台的一个关键限制。例如,金纳米颗粒在纳米技术介导的针对全身癌症的癌症靶向治疗中表现突出,但在全身给药后,金纳米颗粒在脑内的生物分布明显受限。因此,增强纳米载体血脑屏障通透性的FUS等策略可以增强基于纳米技术的靶向治疗在恶性脑肿瘤中的适用性。纳米颗粒借助FUS对于分子靶向已经有吸引力,因为纳米颗粒可以很容易地与小分子控制剂、蛋白质、核酸、配体和抗体以任何组合的形式功能化到纳米颗粒的表面。
四,基因疗法在脑肿瘤中的应用
恶性脑肿瘤病毒基因治疗面临的主要挑战之一是治疗传递的不足。基于病毒的基因治疗恶性脑肿瘤的主要挑战之一是治疗交付的不足。交付策略包括肿瘤内注射、对流增强的输送系统和室内输送。然而,全部3种模式都是侵入性的。此外,还有与毒性有关的问题,特别是与脑室内输送有关的问题。另一方面,血管内给药已被证明是顺利的,但它受到血脑屏障的限制,这可以通过血脑屏障阻断剂来缓解。由于胶质瘤基因治疗策略的目标是侵袭性肿瘤细胞,而这些细胞可能逃脱了手术和放射外科的局部治疗,因此局灶性靶向给药是必要的。因此,FUS可以发挥重要作用。
未来的发展方向
迄今为止的临床前研究表明,带有微气泡的FUS可以顺利地促进大范围的治疗药物向大脑的局部输送。在这方面,FUS有选择性、有针对性地提供服务。此外,成功地将FUS与其他专门的靶向传递系统如纳米颗粒和病毒载体相结合的潜力在分子神经肿瘤学领域具有较大的潜力。此外,FUS在动物脑瘤模型中的应用表明,增强的输送和肿瘤进展的减少与生存的提高之间存在相关性。从临床前的角度来看,同样可以通过fus介导的输送策略来建立顺利性档案。如果这些初步的临床前结果是可持续的,fus介导的输送将在恶性脑瘤的分子治疗中发挥关键作用。
资料来源:Etame, A. B., Diaz, R. J., Smith, C. A., Mainprize, T. G., Hynynen, K., & Rutka, J. T. (2012). Focused ultrasound disruption of the blood-brain barrier: a new frontier for therapeutic delivery in molecular neurooncology. Neurosurgical Focus, 32(1), E3. doi:10.3171/2011.10.focus11252




