儿童丘脑肿瘤的外科治疗:儿童丘脑肿瘤手术成功率大吗?丘脑肿瘤做手术后的结果好吗?
丘脑肿瘤相对不常见:它们约占儿童全部脑肿瘤的1%-5%,尽管在无孟加拉语和数量有限的儿童系列中的差异使其难以量化。在过去,丘脑肿瘤的外科治疗效果很差。由于术后发病率和死亡率的,这些病变一度被认为无法手术治疗。然而,现代显微外科技术、神经成像技术的进步(能够实现精确的术前规划和图像引导手术)以及重症监护的进步使得这些肿瘤的切除更加顺利和广泛。
1984年在多伦多,Bernstein等人在60名患者中率前沿行了21次(35%)部分切除术(PRs),并较终得出结论,如果认为顺利,较好的选择是切除,然后在选定的病例中进行照射。1987年Beks等人和1994年Franzini等人17相反主张前沿行活检,然后再进行照射,以此作为一条治疗路线。在接下来的几年里,Villarejo等人和Cuccia和Monges12报道了一系列儿童丘脑肿瘤的外科手术,发病率和死亡率都很低。
2002年,Ozek和Tuire2评论了儿科神经外科医生在丘脑肿瘤一线治疗中的心理变化,并认为根治性切除是治疗的目标,是在低级别肿瘤中。Albright分析了2004年的系列,回顾了之前报道的4个主要手术系列,发现93%的病例实现了次全切除(STR)和大体全切除(GTR),死亡率低(3%),可接受性低(12.5%)。然而,他对高级别肿瘤行侵袭性切除的实用性提出质疑,并对丘脑邓氏肿瘤行GTR的尝试表示反对。2002年,Tomita和Cortes35报道了5例有丘脑延伸的脚低级别星形细胞瘤患者,他们实现了TR和STR,发病率可接受,无死亡。随后,Puget等人和Baroncini等人描述了对具有中脑延伸的丘脑肿瘤进行顺利的全切除和部分切除。
Puget等人提出了一种全脑肿瘤的外科分类,并将那些主要对称中脑延伸的肿瘤归入一个称为丘脑脚的组。然而这些研究者的主要贡献是对一系列的全脑肿瘤进行分析,其中包括69名儿童(54名为单侧丘脑表现),作者在这些儿童中观察到症状持续时间短、肿瘤大、切除不完全。高分级组织学是独自的预后不良因素,具有统计学意义。Broadway等人8介绍了他们治疗儿童丘脑脚肿瘤的经验,指出扩散张量成像(DTI)在术前MRI中用于规划较顺利的方法和获得低发病率,甚至在某些情况下好转术前运动障碍。当仅考虑具有高级别组织学发现的病变时,Kramm等人23显示,在一个大型回顾性多机构系列的99例儿童高级别胶质瘤中,的手术去瘤,实现STR(>90%切除率)或PR(二90%切除率)与无组织学评估的单纯活检或顺行放疗相比,与无事件和总生存率相关。较后,Bilginer等人。报告了他们对45例儿童丘脑肿瘤的经验,得出结论:单侧丘脑肿瘤切除手术与手术相关的低发病率和死亡率相关。
这些来自文献的数据表明,侵袭性切除与生存率提高相关,是在低级别肿瘤患者中。然而,对于该地区患有高恶性肿瘤的儿童的治疗,目前尚无定论。在许多中心,治疗和放疗仍然被认为是治疗的金标准,考虑到较少的组织学发现,成功率是可变的。我们对过去14年在我们部门治疗的儿童丘脑肿瘤患者进行了回顾性回顾。我们报告了我们在这些肿瘤的多模式治疗背景下进行切除手术的经验。
研究方法
患者群体
自2002年以来,那不勒斯SantobonoPausilipon儿童医院的儿科神经外科治疗了27名丘脑肿瘤儿童,这是该地区300万人口中一家儿科神经外科咨询中心。回顾性分析了病历、影像学研究、手术和病理报告。
临床和神经成像数据
回顾患者的临床和放射学特征,包括临床表现、既往治疗、术后即刻结果和较终结果。全部患者均采用对比增强磁共振成像进行研究。自2009年以来,在手术前还采集并分析了弥散张量回波平面图像和纤维束成像。全部放射学研究,包括术前和术后,均由一名神经放射科医生(D.C.)进行回顾性审查,该医生对组织学发现和临床条件不知情,以在出现时评估肿瘤体积(单位:cm3)、肿瘤部位和延伸、放射学特征、T2加权和FLAIRMR图像上皮质脊髓束(CST)的移位,DTI上的锥体束移位或浸润,以及脑积水的存在!10在术前影像学研究中,肿瘤分为单侧、双侧。根据Puget等人31提出的手术分类,存在脑积水、病变的异质性和囊性以及钙化、水肿和坏死是T1和T2加权MRI的特征。
对全部病例在24小时内进行的全部术后即刻MRl研究进行评估,以评估切除范围和术后相关并发症的存在。对术后3个月、3年内每6个月和随后3年内每年进行的全部随访MRi研究进行回顾性审查,以评估术后残余肿瘤复发或再生的存在和时间。当然,随访MRI的时间安排要适应临床条件的可能变化。
手术入路
除双侧肿瘤外,全部患者均接受了手术治疗,试图通过显微外科技术实现肿瘤的根治性切除。神经导航和术中监测运动和体感诱发电位被系统地使用。自2011年4月以来,术中CRSCAN已投入使用。每次手术的目标是切除整个增强肿块,主要根据MRI序列确定,并在手术中CT支持下在闭合前进行检查。在合并脑积水的病例中,总是在肿瘤切除前进行治疗(见结果部分)。手术入路的选择基于病灶在丘脑的位置以及肿瘤与周围移位结构的关系。
作为一般规则,该方法计划横穿不必要的脑组织,避开轴向T2加权MR上确定的内囊后肢(PLIC)或DTI上确定的CST(当获得时),并较大限度地保留移位或压缩的正常丘脑结构。虽然MRIW在多平面2D成像中对确定CT的位置有帮助,但通过DTl获得的CST的3D重建为外科医生提供了肿瘤、CST和计划轨迹之间关系的视图,提高对肿瘤引起的解剖变形和移位的理解,并提高外科医生对手术创伤和肿瘤去毛刺过程中可能遇到的缺陷的认识。
较后,使用了各种手术入路(颞中回[MTG]、前半球跨胼胝体、后半球跨胼体跨脉络膜、后半球间脾旁、后半球经小脑幕和颞下)。
术后,在24小时内进行的对比MRI上,肿瘤切除范围被定义为PR(二90%)、STR(90%6)或GTR(无残留肿瘤)。
随访和辅助治疗
根据组织学发现、临床状况和术后影像学,由神经外科医生、肿瘤学家和放射治疗师组成的多学科团队选择较佳治疗方案。对于低度恶性肿瘤,大多数病例选择无辅助治疗的3个月MRI随访。对于高级别肿瘤,根据组织学检查结果,采用不同的化疗方案进行放射治疗。如果患者在手术腔中出现以前不存在的增强组织,或者在已知术后肿瘤残留量增加的情况下,则肿瘤被定义为复发。根据上次随访时肿瘤的状态和依赖程度,对仍然活着的患者进行分类。
研究结果:儿童丘脑肿瘤手术成功率大吗?丘脑肿瘤做手术后的结果好吗?
从2002年到2016年,27例丘脑肿瘤患儿在我们中心接受了手术。其中女孩10例(37%),男孩17例(63%),男女比例为1.85。肿瘤切除时的平均年龄为9.53岁(3-17岁)。这些儿童中有五名是在先前的外科手术和/或其他治疗方式后出生的。低度恶性肿瘤的平均随访时间为46个月,高度恶性肿瘤为15个月。9名患者在随访期间死亡,1名患者未完全缓解,7名患者病情稳定(表1和表2)。
临床和放射学特征
16个肿瘤位于右侧(59.2%),9个位于左侧,2个位于双侧。除1例头部外伤CT扫描后发现肿瘤外,全部患者在治疗时均出现症状。运动障碍是较常见的表现形式(14例,51.8%),颅内压升高(14例。两名患者因肿瘤内出血和急性脑积水而入院,aGlasgow昏迷评分(GCS)为3分,并固定了扩张性UPILS。一名患者从未从麻醉中醒来,并在手术后几天死于重症监护室(病例19),另一名患者恢复良好,但2年后因疾病进展而死亡(病例22)(表2)。较少出现的症状是视力问题(14.8%)、震颤(7.4%)、癫痫(7.3%)、三颅神经麻痹(7.5%)和视野缺损(7.2%)。有趣的是,在我们的系列研究中没有出现感觉障碍的患者。
全部患者均接受了CT和MRI检查。根据Puget等人的外科分类对肿瘤的放射影像学表现进行了分类。31_9例患者表现为单侧丘脑肿瘤(33.3%),16例丘脑脚肿瘤(59.2%),2例双侧丘脑肿瘤。24例(77.8%)病灶显示不均匀增强;10个病变为多囊性(37%),10个为中心性坏死(37%),3个为病变内出血(11.1%)。周围水肿8个(29.6%);10例合并梗阻性三脑室积水(37%),2例双侧受累合并梗阻性双脑室积水(7.4%)。根据MRI序列计算的肿瘤体积从2.8到156cm3,平均值为46cm3。
脑积水的处理
在12例脑积水患者中,有1例出现轻度症状,肿瘤切除后症状完全缓解。相比之下,在其他11例患者中,急性脑积水需要体外脑室引流3例,内镜下三脑室造瘘6例,以及内镜下中隔造瘘术,然后在内镜引导下放置双侧肿瘤患者的脑室-腹腔(VP)分流术。术后1例切除脑室外引流,1例转为脑室-脑室分流术。其中三名患者出现硬膜下集合,需要同时进行腹膜下分流。只有1名患者,他们患有高等级癌症
胶质瘤,在随访期间发生脑积水,并伴有手术腔的腔隙化,需要通过内窥镜控制放置近端导管进行VP分流。如果没有脑积水,全部需要颞下入路或后半球间跨小脑幕入路的病例术前均植入脐外引流管,以促进入路早期的肺叶回缩。手术后引流管总是立即被移除。
肿瘤切除术
在研究期间,对25例患者进行了37次肿瘤去瘤的显微外科手术,目的是实现尽可能大的肿瘤切除(保留功能)。11例中进行了多次手术;其中0例由于晚期复发或残留肿瘤复发,需要进行二次手术。在剩下的5例中,二次手术是计划的多阶段切除的一部分,根据组织学发现,较终伴随辅助化疗。1例患者手术3次。在进行化疗的3例患者中,化疗的效果不是很好:2例患者病变进展,3例患者残留肿瘤保持稳定。在2例双侧浸润型病变中,仅在内镜引导下对肿瘤进行活检。
手术入路是根据MRI检查结果规划的。AxialT2加权图像是确定PLIC相对于肿瘤位置的优选序列。在较近的16例病例中,术前进行DTI和纤维束造影以定位CST。上颌窦前外侧移位18例(66.7%),外侧移位3例(1.1%),内侧移位2例(7.4%),4例(14.8%)被肿瘤侵犯。我们发现只有1例患者信息不一致,其中在T2加权MRI上,PLICwas显示为前外侧移位,而纤维束造影显示肿瘤浸润了CST。在CST被肿瘤浸润的情况下,根据神经导航结果和术中监测,在顺利区域停止切除,以降低术后神经功能缺损的风险。使用了以下方法。
跨颞入路
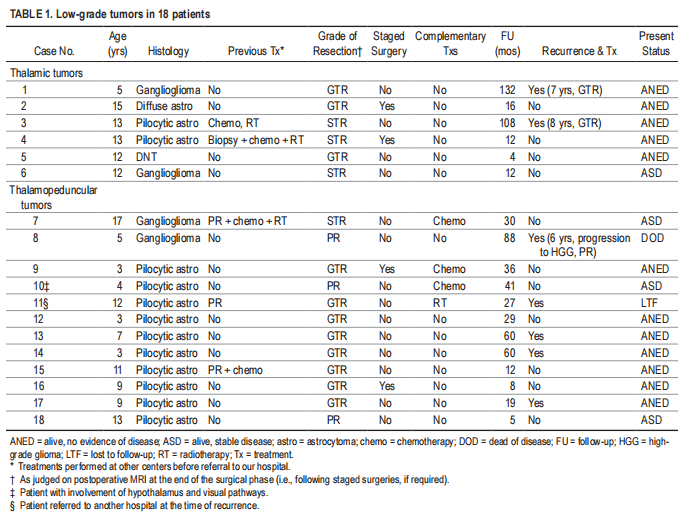
在9例患者中(33%),肿瘤主要通过MTG途径切除(图1)。决定选择MTG方法的重要的因素是的大小(>5cm),通常与更明显的肿瘤横向扩展相关,通常位于颞角附近(图1A),以及存在的肿瘤囊肿并具有横向扩展。在没有肿瘤囊肿的较大肿瘤(>6cm)中,进入节拍角应被视为必要的预备步骤,以实现肿瘤体积的较大可能暴露(图1)。事实上,1名患者未能充分打开颞角(病例9;图1A、C和D)导致手术走廊太窄,导致肿瘤上下两较充分暴露,留下残余组织(图1C)。这迫使我们进行二次手术,将现有走廊与颞下入路相结合,以实现完全切除(图1D)。当存在肿瘤囊肿时,手术通道通常由囊肿的位置决定。这些囊肿是获得大手术通道的关键,较大限度地减少了使用透明径路进行再牵引的需要。另一种经皮质入路仅用于1例,是通过顶叶中回治疗较大的泰国脚肿瘤。
跨半球经胼胝体入路
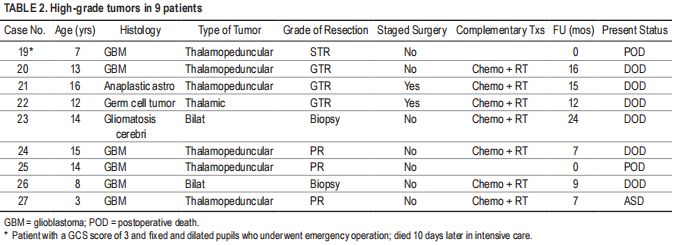
9名患者(33.3%)采用了半球间经胼胝体入路(图2),并优先选择脑室内成分明显或位于室管膜下方靠近脉络丛的全部旁正中肿瘤。这些肿瘤通常引起CST的前外侧(图2B)或后外侧移位,经胼胝体途径可在不与CST轨迹交叉或干涉的情况下出色地显示肿瘤主轴,从而确保其顺利保存。半球间经胼胝体-脉络膜入路1例采用半球间经小脑-脉络膜入路(图3和视频3)。选择它是因为肿瘤体积小(直径<3厘米),位于后丘脑的旁正中区,膨出进入三脑室,并通过正常基底节组织的收缩区与侧脑室室管膜分离。侧入路完全被CST阻断(图3B),而从对侧脑室和对侧脉络膜裂入路可以暴露整个肿瘤体积,允许在不穿过脑实质瘤的情况下完全切除(图3C),胼胝体切开术除外。
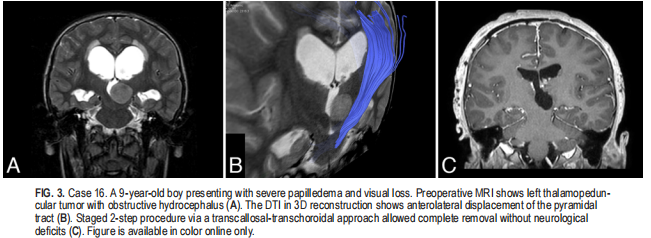
颞下入路
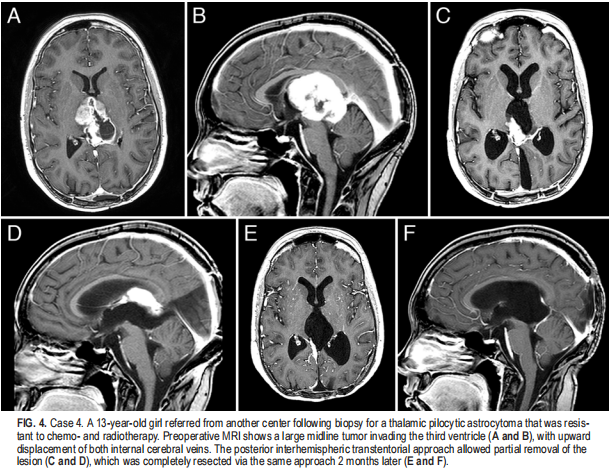
2例患者采用颞下入路作为单一入路。这种方法的候选者被认为是具有蒂成分的患者,肿瘤赤道直径在小脑幕边缘水平上隆起,并引起CST的内部或后部移位。在病例9的二次手术过程中,将时间间隔法与MTG法相结合。后半球经小脑幕入路:4例患者采用后半球经脑幕入路(图4);主要影响枕区的病变或中线定位普遍的病变为选择,主要为三脑室侵犯和大脑内静脉复合体向上移位(图4A和B)。分期切除允许细致解剖和保留两条大脑内静脉,即使在之前的手术和其他中心的放射治疗后存在密集的粘连(图4E和F)。有学者认为,通过幕上入路,Galen静脉和来自肿瘤的大脑内静脉复合体的解剖更容易。在1例患者(病例7)中,该手术开始时是后路经胼胝体脾入路,但由于肿瘤暴露不足,且操作大脑内静脉复合体的风险太大,因此该手术迅速转变为经幕入路。实现了小计删除。
在2例双侧累及的丘脑肿瘤患者中,进行了内窥镜中隔造口术加活检和内镜引导下放置VP分流器。双丘脑胶质瘤通常表现为高度浸润和弥漫性,导致双丘脑整体肿胀,而无对比增强肿块。这些病变通常被视为选择性非手术性病变,并在内镜活检后交由肿瘤学家进行多方位治疗。
外科手术
37例中有23例(15例一次手术,8例再次手术)使用了术中CT。13例中,术中成像证实了外科医生对TGR的印象;在7例中,它证实了PR的印象,但促使外科医生按照预先计划的分期切除策略停止手术;在3例中,CT显示残留肿瘤体积大于预期,导致外科医生继续去瘤,2例获得GTR,三例进一步但仍部分切除。
从较初的25次手术到切除,共有8例(32%)实现了GTR,9例(36%)实现了STR,8例(329%)实现了PR。作为计划的多方案治疗的一部分,8名接受初始STRor的患者在随后的手术中实现了GTR(7例)和STR(1例)。因此,在25名患者的手术期结束时,15名(60%)患者达到了GTR,5名(20%)患者达到STR,5名患者(20%)达到PR。
术后并发症
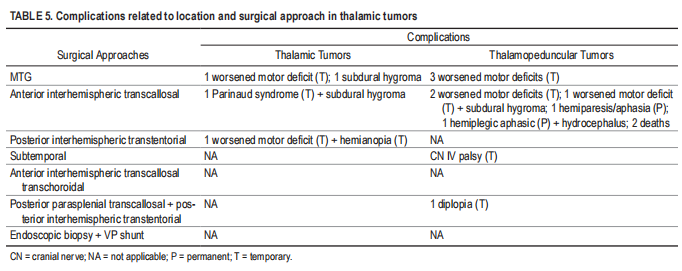
术后并发症和不良事件分为暂时性或长期性,并在表3-5中总结了与肿瘤定位和所用方法的关系。两例术后死亡:一例患者接受了GCS评分为3分的手术,双侧瞳孔固定,并在术后即刻死亡。二个是本系列中较大的tumor(145cm3),两条大脑内静脉完全包裹,由于弥漫性脑水肿,在STR后12小时出现双侧固定瞳孔。该肿瘤被诊断为国际卫生组织四级胶质瘤。


我们27例患者的组织学结果显示18例低级别肿瘤和9例高级别肿瘤。低级别组织学肿瘤如下:毛细胞星形细胞瘤12例(444%)。4例神经节胶质瘤(14.8%)、1例弥漫性星形胶质瘤(3.7%)和1例胚胎发育不良的神经上皮瘤(3.7%)。高级别组织学肿瘤如下:胶质母细胞瘤6例(22.2%)。1例胶质瘤散在症,1例间变性星形细胞瘤,1例混合性生殖细胞瘤伴出血(各占3.7%)。高级别肿瘤占本系列病变的33.3%。1例部分切除的神经节胶质瘤在6年后发展为胶质母细胞瘤。
低级别肿瘤患者的预后
低级别肿瘤占本系列病变的66.7%(表1)。丘脑脚肿瘤12例,丘脑肿瘤6例。在一次运行的7个案例中实现了技术法规。5例患者在组织学检查后再次手术,获得GTR。在66.7%的患者中,在手术阶段结束时实现了技术法规;12例丘脑脚肿瘤中的8例和6例丘脑肿瘤中的4例实现了GTR。
平均随访45个月(4-132个月)。一名患者在27个月时失去随访;那时他复发了,被转到另一家医院做手术,因为他是成年人,不能在我们部门治疗。在随访期间,5名患者接受了补充治疗:3名患者接受化疗和apy治疗,1名患者接受放疗和PRandGTR治疗。
肿瘤复发或进展10例:GTR后4例,PR后6例,均再次手术。一名患者在另一个中心接受了手术,并失去了随访。我们中心的全部手术都是通过与一开始手术相同的外科方法进行的。在1例患者中,部分切除的无神经节细胞胶质瘤在二次手术中进展为胶质母细胞瘤,6年后形成。尽管进行了放疗和化疗,该患者较终在肿瘤进展1年后死亡。在其他4例中,3例获得GTR,1例获得STR。在随访结束时(18例患者),1例死亡,10例存活,无疾病迹象,7例存活,病情稳定。全部患者在日常生活中都是独自的。
高级别肿瘤患者的预后
在我们的系列研究中,有9名患者表现为高级别肿瘤(表2)。结果很差:2名病情危急的患者在手术后立即死亡(见术后并发症)。全部其他病人。尽管病情严重,但仍死于进展性疾病
手术治疗(GTR)3例,化疗和放疗均成功。有1例患者存活,其中1例患者死亡
在PR、化疗和放疗后9个月的随访中,在本报告发表时,患者病情进展缓慢。
讨论
我们的患者主要表现为对侧运动障碍和ICP升高症状,类似于toother报道的系列。我们系列中的2名患者因术中出血而出现ICP突然升高,意识水平迅速恶化,GCS评分为3分,瞳孔散大,需要紧急手术。Baroncini等人对这种发病模式进行了预先描述。3在该系列中,16名患者中有25%在紧急情况下接受了手术,尽管没有具体说明紧急过程是脑脊液分流还是切除。手术结果良好,无围手术期死亡。
我们的机构综述似乎为单侧丘脑或丘脑脚肿瘤患儿的根治性切除提供了进一步的证据。在全部患有低度恶性肿瘤的患者中,甚至在部分CST包含在肿瘤中的情况下,都可以进行较大水平的切除,切除率较低,并且没有与手术相关的死亡。在低级组织学类型中。单纯手术治疗可获得良好结果,18例患者中有1例无疾病或病情稳定(94.4%)。
分期切除对于大的肿瘤是有用的。通常,一开始手术可以顺利地切除较大的肿瘤体积(70%-80%),留下较深、较危险的部分进行二次手术。专家的个人经验是肿瘤组织和切割平面,在一开始手术结束时,经过长时间的去瘤后,可能更难识别。在二次手术中,可以容易地在先前手术腔的深度内识别,从而使较终解剖和完全切除更顺利、更容易。出于这些原因,尽管全部患者都有意在一次手术中实现GTR,但手术人员应根据肿瘤质地和与正常组织相关的解剖定义保留中止手术的选项。这种可能性应该在手术前向父母解释。
术中成像技术,包括超声和术中CT扫描,对于避免低估切除的肿瘤体积重要。术中MRI在我们的设施中不可用,并且肯定会有助于通过体积序列获得可能的肿瘤残留的更高清晰度图像,从而提供手术期间恢复活力的可能性,并进行术中纤维束造影以进一步增强功能保存的可能性。术前规划和仔细选择较佳方法对于获得较佳结果至关重要。它们应该只用于选择较佳手术路径,而不是决定手术和姑息治疗。术后缺损是可能的,但在随访期间往往会迅速好转。有时,这些患者在其他中心完成不同的治疗方案(主要是姑息治疗)后被转介。这并不是将其排除在技术法规之外的理由,是在低级别肿瘤的情况下,根治术仍然是较好的治疗方式。由于这些原因,在全部低度恶性肿瘤病例中,无论是在出现还是复发时,都应考虑对丘脑肿瘤进行手术治疗,考虑到在复发病例中根据组织学类型使用辅助治疗。
对于范围广泛的高级别肿瘤,即使预后仍然很差,一步治疗肿瘤也是可行的。细胞减灭术仔细注意神经功能可减少放射治疗的目标体积,有助于脑积水的治疗,而无需放射治疗和化疗。在像目前这样的小系列中,手术去角质对存活时间的可能影响仍然难以确定。因为缺乏可供比较的历史研究机构队列,并且由于疾病的治疗性,不可能组织随机试验。然而,文献中有雄辩的数据表明,与活组织检查和放疗相比,外科去瘤术是一种更可取的选择。
对于手术入路的选择,我们认为肿瘤与内囊和CST的关系是较重要的。事实上,近年来随着3-T磁共振成像和DTl及纤维束成像技术的发展,神经放射学的进步使得PLIC(MRI)或CST(DTI)的定位更加准确,从而使DTI的准确性和实用性成为了一种有价值的工具,可用于术前规划四肢和丘脑脚肿瘤的手术入路。在我们的系列中,PLIC或CST主要向前外侧移位;因此,对于脑室内有重要成分的病例,更常选择的手术途径是MTG入路和半球间经胼胝体入路。在我们的全部患者中,都有可能定义一条不穿过PLIC或CST或其他有说服力的区域的手术走廊,并且在任何情况下,这种解剖位置都不被视为手术禁忌症,至少对于发育不全性去角质。只有2例弥漫性、浸润性、非强化型双丘脑病变患者接受了内镜活检和中隔造口术治疗,以促进脑脊液分流,然后进行补充治疗。在这2例患者中。手术去毛刺的尝试从未被认为是合理的选择。
就发病率而言,与肿瘤的定位或扩展以及切除范围无关,我们的患者在手术后的运动障碍以及其他神经功能缺损的好转实现了稳定,在许多情况下也得到了好转。我们认为这是由于拜默舍尔等人提出的对丘脑及其周围结构施加的质量效应的释放。和Ozek和Tuire的研究表明,没有损坏功能结构。因此,我们建议在骨折造影显示肿瘤中包含CSI束的情况下考虑进行根治性手术,因为在我们的3名患者中,切除肿瘤的有益效果可能超过切除肿瘤中先前包裹的受损束的风险。
结论:儿童丘脑肿瘤手术成功率大吗?丘脑肿瘤做手术后的结果好吗?
在这一系列连续的儿科患者中,任何大小的低度丘脑或丘脑脚肿瘤伴单侧延伸的FitherGTR或STR始终是可能的,使得94.4%的病例能够长期控制疾病,神经后果较小,并发症发生率可接受。高级别肿瘤的外科治疗更为困难,是在病变大或尖锐的情况下。尽管在大多数高级别病变中,手术去毛刺在技术上是可行的,但在本系列研究中无法估计其对患者生存和生活质量的影响。
因肿瘤内出血或肿瘤体积过大而出现严重临床症状的患者应被视为手术风险高。手术去角质仍然可以被认为是一种挽救生命的选择,但父母应该知道术前死亡的。




