作为国际小儿神经外科领域的专家以及INC国际神经外科顾问团成员,加拿大多伦多大学儿童医院SickKids大外科主任、脑瘤研究中心主席James T.Rutka教授一直致力于儿童髓母细胞瘤的治疗与研究。在其A functional genomics approach to identify pathways of drug resistance in medulloblastoma论文中,他发现功能基因组学方法可帮助鉴定髓母细胞瘤中耐药性的途径。以下为论文的主要内容:
髓母细胞瘤(MB)是常见的恶性小儿脑肿瘤。尽管在我们对髓母细胞瘤的理解上已经取得了不断的进步,但是关于它的病因和治疗仍然存在疑问。髓母细胞瘤在人口统计学,临床和分子上分为四个不同的亚组,称为WNT,SHH,3组和4组,并进一步分为其他不同的分子亚型。尽管(WNT)途径驱动的髓母细胞瘤患者有良好的预后,但在其他亚型(例如倾向于局部复发的SHH以及3和4组,与远端转移相关)中,复发率更高。转移性髓母细胞瘤的生物学与原发性髓母细胞瘤不同。代表潜在的其他治疗疾病。需要确定在髓母细胞瘤的原发性和转移性区室中的治疗抗性途径的方法,以指导靶向治疗的选择。例如,MET原癌基因在SHH和3组髓母细胞瘤中被上调,并且可以通过用小分子控制剂Foretinib治疗细胞和小鼠模型来靶向。我们利用了由睡眠美容诱变转座子系统驱动的髓母细胞瘤的自发转移小鼠模型,以查明原发性和转移性髓母细胞瘤的功能驱动器和对Foretinib的耐药途径。这是一种同时解剖多个肿瘤部位的治疗抗性模式的新颖方法,可以很容易地应用于其他癌症系统。
方法
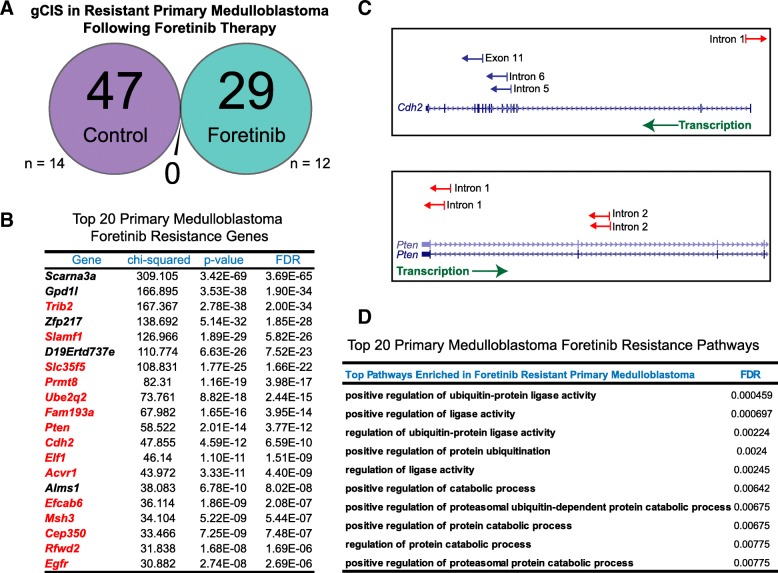
自发发展为具有100%渗透率的原发性和转移性的髓母细胞瘤Sleeping Beauty转座子诱变小鼠模型(Ptch+/-,SB100/SB68,T2Onc)被用于确定Foretinib耐药性的途径(图1a)。该系统允许包埋癌基因和抑癌基因,这可以通过转座子插入位点的下一代测序来鉴定。先前我们证明了Foretinib是SHH和3组髓母细胞瘤小鼠模型中MET途径的合适控制剂(图1b)。在30-35天的时间范围内建立肿瘤后,通过连续渗透泵以每小时0.25μl的速度向脑脊液中输注28天,用溶媒或Foretinib治疗小鼠(图1a)。收集抗药性的原发性和转移性肿瘤,并通过SPLINK PCR结合末端Illumina高通量测序鉴定基因组共同插入位点(gCIS)(图1a),以查明治疗耐药性的遗传驱动因素。

结果和讨论:
我们利用Sleeping Beauty转座子系统来确定对Foretinib的耐药途径,这作为一种概念验证策略,可以应用于其他癌症模型和系统。在原发性髓母细胞瘤中,用Foretinib治疗的小鼠中的gCISs模式与对照小鼠高度不同,因此支持原发性髓母细胞瘤的潜在机制与接受Foretinib治疗的肿瘤不同(图2a)。在经Foretinib治疗的原发性肿瘤中,我们在已知的肿瘤癌基因和抑癌基因如Pten,Cdh2,Egfr和Acvr1b中确定了特异性插入(图2a-c)。作为两个例子,通过PTEN插入的位置和反义方向在引入早期poly A转录终止信号的基因的5'末端内,评估PTEN插入是失活突变。预计CDH2插入会促进CDH2的小异构体的表达和/或消除基因的长异构体的表达。与癌症数据库中的《体细胞突变目录》相比,这些候选物中的大多数已被证明在癌症中发生了突变,并且其中一些先前已被证明与脑肿瘤发生有关(图2b)。此外,在原发部位肿瘤中介导福瑞替尼耐药的机制被蛋白质代谢相关的途径过度代表,特别是泛素介导的蛋白质降解(图2d)。我们的发现表明,患有髓母细胞瘤并接受Foretinib治疗的小鼠表现出与原发灶不同的途径改变。通过Sleeping Beauty转座子插入分析确定的这些途径代表了Foretinib抗性髓母细胞瘤的候选驱动因素和潜在靶标。
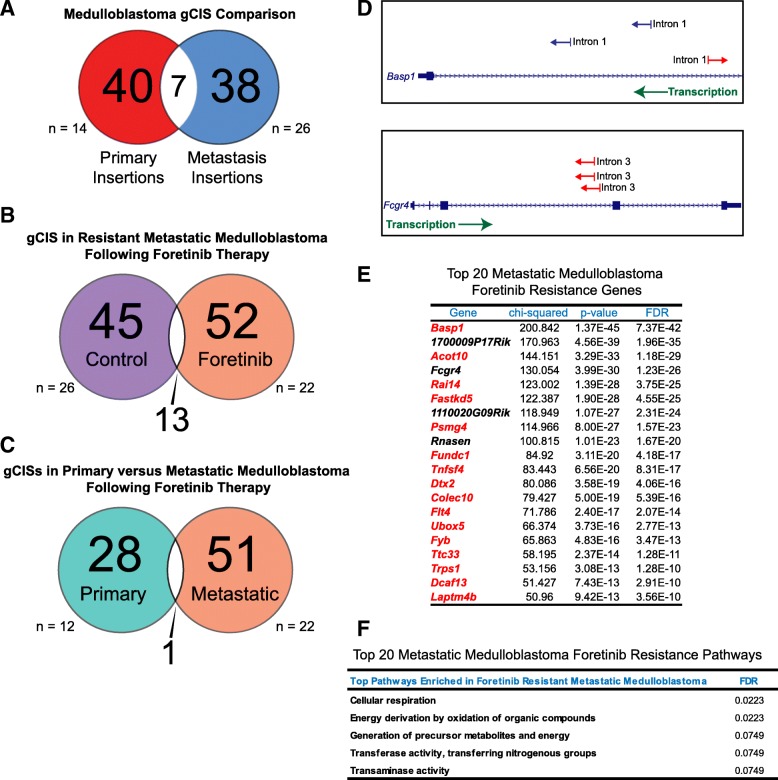
从历史上看,转移性疾病被认为与原发肿瘤高度相似,因此据推测对旨在针对原发性病变的治疗具有同等的反应。使用Sleeping Beauty转座子系统,我们显示原发性和转移性髓母细胞瘤表现出不同的遗传改变模式(图3a,附加文件1:表S1-S4)。在原发性髓母细胞瘤中鉴定出的gCISs包括转录调节剂(例如Crebbp和Ep300)以及转移性髓母细胞瘤中与免疫反应相关的基因(例如C6,A2m和Pkp2)(附加文件1:表S5-S8)。这些数据支持髓母细胞瘤的主要和转移区室由不同的分子机制驱动。接下来,我们询问与原发性治疗的肿瘤相比,转移性髓母细胞瘤是否可能发展出不同的或会聚的耐药途径。我们发现接受福瑞替尼治疗的转移性髓母细胞瘤与载体治疗的小鼠的转移隔室相比表现出不同的基因组插入模式(图3b)。此外,转移性gCIS与小鼠的原发区室高度不同,小鼠也接受了Foretinib治疗(图3c)。耐受Foretinib的转移性成神经细胞母细胞瘤插入物包括Basp1,Flt4,Mllt10和Asxl2(图3d,e)和参与细胞代谢的途径(图图3f)。这些发现表明原发性和转移性髓母细胞瘤在分子上是不同的。因此,它们对治疗的反应和耐药性可能会大相径庭。此外,我们证明了功能基因组作图的功效,可同时识别不同肿瘤区室中肿瘤发生的推定驱动器。
结论:
我们的研究已经确定了成髓细胞瘤细胞可能协同克服Foretinib控制的潜在途径,并提供了一种策略,可以确定针对其他成髓细胞瘤靶向疗法的耐药性途径。这些途径的前瞻性鉴定可用于确定对耐药原发性和转移性肿瘤克隆合适的联合治疗。我们进一步在我们的模型中证明原发性和转移性髓母细胞瘤在遗传上是不同的,并且对Foretinib疗法的反应显示出不同的耐药机制。我们方法的局限性在于,虽然可以确定驱动途径,但它们可能不能代表靶向抗性人类原发肿瘤的确切基因。因此,使用这种“睡美人方法”的综合功能小鼠建模与耐药原发性肿瘤的基因组学特征配对,可以优先考虑介导癌症治疗耐药性的途径和特定靶标。较后,我们的数据支持在原发部位对抗遗传靶点的治疗可能对转移性病变无效,并且在接受治疗的原发性和转移性髓母细胞瘤之间可能发生明显的遗传进化。




