恶性脑胶质瘤手术的目标是在保持生命质量的同时优化切除范围(EOR)。荟萃分析表明,总的全切除术可好转胶质母细胞瘤的无进展生存期和总生存期(OS)。在连续的队列中,有500个新诊断的胶质母细胞瘤,提高了生存获益,即使在95-100%的切除范围内,也观察到总生存期的逐步好转。有趣的是,在243个胶质母细胞瘤中,在调整偏倚后进行多变量分析时,全切除术的生存优势仍然很。关于间变性胶质瘤,术后MRI上残留的肿瘤体积可评估肿瘤进展和总生存期的时间。
手术的全切可能具有挑战性,因为由于其浸润特征,是在白光显微镜下,可能难以识别胶质瘤的边界。因此,为了提高恶性胶质瘤的术中实时可视化,利用荧光引导手术(FGS)的一直主张,与5-氨基乙酰丙酸(5-ALA)作为手术的更佳选择。与传统的白光显微外科手术相比,术中荧光成像使高级神经胶质瘤的切除范围增加,如一项提出性的随机对照试验所证明的。这项研究的优点还在于强调需客观评估胶质母细胞瘤手术后MRI的切除范围。在此前沿杂志中,荧光和其他光学成像技术在肿瘤外科手术中的应用得到了强调,特别是对于恶性脑肿瘤。尽管在过去十年中有关该主题的文献很多,但由于实质性局限性,仍可能讨论FGS对神经胶质瘤患者的实际益处。
从肿瘤学的角度来看,除5-ALA不适合显示弥散性低级神经胶质瘤外,荧光引导切除可能自相矛盾地限制了高级胶质瘤的切除范围。确实,较近有人提出,扩大切除术(包括切除增强周围的边缘)可能会好转胶质母细胞瘤的总生存期。较初的概念是基于这样的事实,即复发大多发生在手术部位的周围,那里存在促进胶质母细胞瘤生长和侵袭的特定肿瘤和基质细胞。
Li等人在一个队列中有1229个胶质母细胞瘤。据报道,除总的增强造影剂切除术外,还进行了FLAIR加权MRI周围异常≥53.21%的切除术时,总生存期延长了20.7个月,而单独切除增强术则为15.5个月。因此,尽管5-ALA超出了增强造影剂的范围,但由于其扩散仍被减少,与该方法本质相关的肿瘤学风险是过早停止通过荧光识别的肿瘤块的切除术,同时可选地行肺叶切除术在非功能区域可以完整切除FLAIR异常,从而对总生存期产生更好的影响。从功能的观点来看,5-ALA的相同特性超出胶质瘤的增强部分,可能导致涉及脑功能必不可少的结构的肿瘤长期性神经功能恶化。例如,DíezValle等报道了在使用5-ALA进行手术的胶质母细胞瘤系列中,新的或增加的神经系统学恶化率为8.2%,也就是说,与较近进行的荟萃分析中使用术中电图测绘的结果相比,术中电测绘的结果为-3.4%。
因此,克服这些局限性的替代方法是通过术中皮质直接电刺激(DES)定位运动区皮质,从荧光引导切除切换到功能引导的切除。实际上,De Witt等人的荟萃分析在超过8,000名患者的基础上,研究了术中电测绘对神经胶质瘤手术结局的益处,证明使用DES切除高级别神经胶质瘤和低级别神经胶质瘤的手术切除率与根治性切除术相关,并且较低的严重长期性损伤率,即使位于脑功能区的肿瘤也是如此。有必要强调的是,由于使用了荧光,这种好转的切除范围与发病率同时降低相关的证明,与使用术中功能绘图的一系列报道的结果相比【目前被认为是神经胶质瘤手术的护理标准】,仍然缺乏。
值得注意的是,已经提出将5-ALA和电生理标测相结合,特别是对于侵入关键区域的神经胶质瘤。但是,即使从技术上讲,没有使用这两种方法的对立面,荧光引导手术切除在概念上也与基于功能映射的切除不兼容。确实,尽管5-ALA引导手术的目的是去除神经胶质瘤的增强部分,但在功能上可行时不进行超细致的切除或在功能性结构中造成持续性缺陷的双重风险(因为从本质上讲,它不能提供功能性信息),制图指导手术的目的不是实现“肿瘤切除术”,而是对由弥散性肿瘤疾病侵袭的实质进行较大水平切除。换句话说,目的是推动切除术直到在皮层和皮层下都遇到功能区结构,而在这些功能边界周围不留余量。实际上,如果5-ALA和DES给出的信息存在差异,则神经外科医生应依靠功能图谱。例如,如果荧光显示残留的神经胶质瘤,但电测图显示其侵犯了功能组织,则需停止切除以保存神经网络。另一方面,如果5-ALA表现出“完全”的肿瘤切除,但根据DES尚未达到功能区结构,则应进行切除直至功能较限。
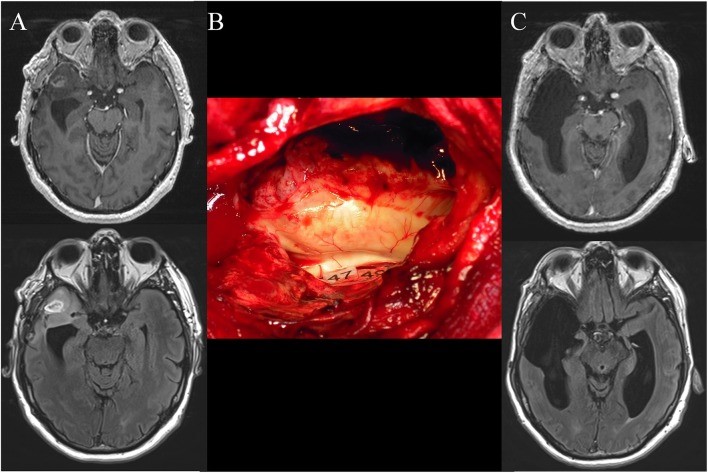
以上图片案例显示了一名患有癫痫发作的50岁右手男性在术前进行了轴向增强的T1加权MRI(上部)和FLAIR加权MRI(下部),从而发现了右前颞上高度神经胶质瘤。该患者先前在另一家医院接受全麻麻醉下的“微创图像引导手术”,部分切除了增强和FLAIR高信号。诊断为间变性星形细胞瘤。当时,患者被咨询过来,并建议进行清醒手术,以根据功能范围进行全切。神经系统检查正常。尽管如此,术前的神经心理学评估显示,较高的认知功能(即心理理论和语义加工)略有不足。(B)切除后的术中视野,直至功能区结构,是在皮下层。实际上,直接电刺激白质束能够识别参与心理理论(精神化)(标签47)和非语言语义(标签49)的皮层下神经网络-这些神经网络已根据术前神经认知的结果进行了映射评定。(C)术后轴向增强T1加权MRI(上部)和FLAIR加权MRI(下部)(在切除后3个月进行)表明增强和FLAIR高信号的扩大范围切除。手术后进行认知康复,神经心理学检查得到好转。诊断为弥漫性的WHO III级星形细胞瘤(IDH1突变),并进行了术后化疗,没有放疗。经过4年的随访,影像学稳定,患者继续享有正常生活,没有任何症状。
总而言之,以优化肿瘤功能平衡(即好转恶性脑神经胶质瘤患者的总生存期和生活质量)为较终目标,荧光引导手术切除可通过功能指导的手术切除来代替,以达到较大限度地提高高级别胶质瘤的总体生存效益。
INC国际神经外科医生集团提示,随着手术技术的进步和术中设备的更新迭代,保留功能区早已不再困难,除了上文提及的术中皮质直接电刺激(DES)定位运动区皮质,还可以通过术中磁共振、术中神经电生理监测、术中神经导航等高科技手术设备,以实现对功能区的准确定位,以及对脑肿瘤的较大水平切除。
参考文献:doi:10.3389/fsurg.2019.00021




