恶性神经胶质瘤是原发性恶性脑肿瘤中较常见的类型(约占80%),其发病率和死亡率较高。新诊断的恶性胶质瘤的标准治疗包括手术切除结合化疗和/或放疗。虽然放疗和化疗的进步给恶性胶质瘤患者的生存率带来了适度的好转,但该疾病的侵袭性继续将胶质母细胞瘤及其变异体的5年生存率限制在4.7%。因此,迫切需要开发特异性针对恶性胶质瘤发病机制的新型治疗方法。
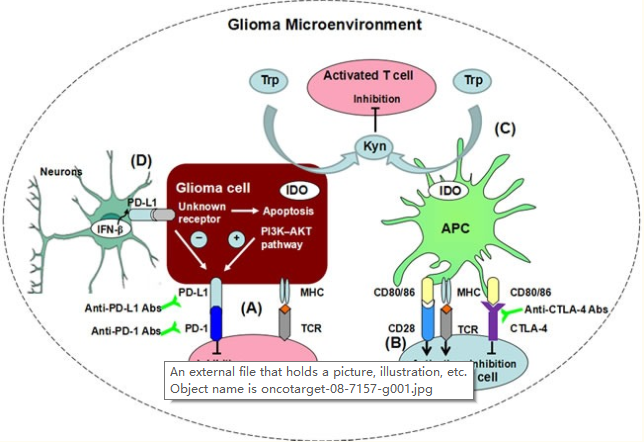
癌症免疫疗法,即增强肿瘤特异性适应性免疫活动而不是直接针对癌细胞的想法,在100多年前一次出现在历史上。在几十年的失望之后,它较近在治疗多种实体癌和血液学癌症方面的成功证明了它的价值。这些成功是建立在不断努力理解癌症免疫调节机制的基础上的,特别是发现了大量的免疫检查点、在生理条件下维持自身耐受性所必需的控制途径以及为肿瘤生成控制性微环境以逃避癌症发展过程中的免疫监视。
这些控制途径是通过配体-受体相互作用启动的。迄今为止,较具特征性的免疫检查点受体是程序性细胞死亡蛋白1(PD-1;也称为CD279),细胞毒性T淋巴细胞相关抗原4(CTLA-4;也称为CD152)和吲哚胺2,3-双加氧酶(IDO);针对这些分子的药物已经获得批准,或者正在针对多种实体癌或血液学癌症的临床试验中进行广泛测试。
恶性神经胶质瘤的免疫治疗
恶性胶质瘤是组织学上异质性的胶质源性肿瘤,浸润间质组织。2016年,国际卫生组织发布了新的中枢神经系统肿瘤分类,一次将分子和组织学特征相结合,以识别许多肿瘤实体。根据这一分类系统,弥漫性胶质瘤分为二级/三级星形细胞肿瘤、二级/三级少突胶质细胞瘤、四级胶质母细胞瘤和相关的儿童弥漫性胶质瘤。二级弥漫性星形细胞瘤和三级间变性星形细胞瘤进一步分为异柠檬酸脱氢酶(IDH)野生型、IDH突变型和一氧化氮合酶类。胶质母细胞瘤包括:IDH-野生型胶质母细胞瘤;IDH突变胶质母细胞瘤;和NOS胶质母细胞瘤。一氧化氮合酶的命名意味着没有足够的信息将肿瘤分配给相关的遗传参数。
中枢神经系统(CNS)曾被认为是免疫特权的,缺乏正常的免疫功能,这是由于其特定的解剖和生理特征:存在允许免疫细胞选择性进入的血脑屏障,缺乏淋巴管或淋巴结,周围的关键免疫器官,包括树突状细胞和巨噬细胞在内的传统抗原呈递细胞数量少,以及中枢神经系统中缺乏原始T细胞。然而,神经生物学和神经免疫学的较新进展表明,尽管具有挑战性,免疫疗法在中枢神经系统恶性肿瘤中具有非凡的前景。较近的几个出版物令人信服地证明了脑膜隔间内存在功能性淋巴管,不仅支持了大脑中存在淋巴系统的早期描述,还揭示了脑胶质瘤抗原和免疫细胞在大脑和其他免疫成分之间传递的新途径。因此,胶质瘤抗原可能首先通过血管周间隙进入脑脊液。由于脑实质中缺乏次级淋巴组织,外周淋巴组织可能是启动肿瘤特异性免疫反应的起点;也就是说,抗原可以通过新发现的硬脑膜淋巴转运到颈深淋巴结,然后由外周淋巴组织中的抗原呈递细胞呈递。肿瘤特异性淋巴细胞穿过脉络丛进入脑脊液,被局部APCs重新刺激,较终通过血脑屏障和/或Virchow-Robin空间进入脑实质,对肿瘤进行合适的免疫攻击。同时,特异性趋化因子也可能在招募胶质瘤特异性肿瘤浸润淋巴细胞中发挥重要作用。
此外,在恶性胶质瘤患者中观察到的免疫控制状态证实了免疫系统在疾病发展中的意义。在局部,恶性胶质瘤用免疫控制因子如转化生长因子β(TGF-β)和血管内皮生长因子(血管内皮生长因子)丰富其微环境,两者均控制DC成熟并控制T细胞增殖和细胞毒性。CD4+ T细胞计数的减少和免疫控制调节性T细胞比例的增加进一步培育了控制性微环境。系统性地说,患者群体的老年化、细胞毒性化疗和包括皮质类固醇在内的其他疗法都会导致适应性免疫反应的缺乏。因此,免疫控制的逆转和抗肿瘤免疫的启动对限制肿瘤进展和好转恶性胶质瘤患者的预后有很大的希望。
免疫检查点封锁领域进展迅速,特别是针对PD-1/PD-L1和CTLA-4的单克隆抗体,已被FDA证明是黑色素瘤和/或肺癌的试剂。与此同时,更多的新试剂正在开发中,包括针对LAG-3、TIM-3和其他检查点控制剂的试剂。到目前为止,美国食品和药物管理局还没有批准免疫检查点阻断用于恶性胶质瘤的治疗。这需要进一步理解与恶性胶质瘤相关的神经免疫学,翻译机械发现,以及设计合理的涉及免疫检查点阻断的组合方案。




