引言:毛细胞星形细胞瘤是一种生长缓慢的肿瘤,是儿童时期较常见的脑肿瘤。恶性转化是少见的,它通常与以前的放疗有关。下文描述了一例毛细胞星形细胞瘤的自发恶性转化。一名3岁男孩被诊断患有小脑肿瘤。他接受了病灶的完全切除,组织学发现符合毛细胞性星形细胞瘤。p53呈阴性。12年后,他出现了局部复发。组织病理学诊断为胶质母细胞瘤,p53阳性。胶质母细胞瘤诊断后16个月,因疾病进展而死亡。
毛细胞性星形细胞瘤约占全部儿童脑肿瘤的25%,较常见的部位是小脑和下丘脑/视神经通路。在磁共振成像上,毛细胞性星形细胞瘤通常是一种界限清楚的病变,标准的初始方法是手术切除。这些患者预后较好,10年生存率高达80%,即使肿瘤切除不完全。有时会发生不利的演变,如恶性转化、局部复发、多中心疾病或软脑膜播散。恶性转化发生在不到5%的病例中,在以前接受过放射治疗的患者中更为常见。
案例报告
一个15岁的男孩在3岁时被送到一家神经外科医院。他是家里的老三,没有已知的神经系统、肿瘤或遗传疾病家族史。3岁时,诊断为右小脑半球囊性肿瘤,并接受了完整的手术切除。组织学检查显示结果符合毛细胞性星形细胞瘤的诊断。虽然观察到轻微的核多态性和轻微的内皮增生,但没有坏死、有丝分裂和微血管增生,Ki-67增殖指数低,p53在免疫染色中为阴性(少于10%的癌细胞核染色阳性;图1A-C)。
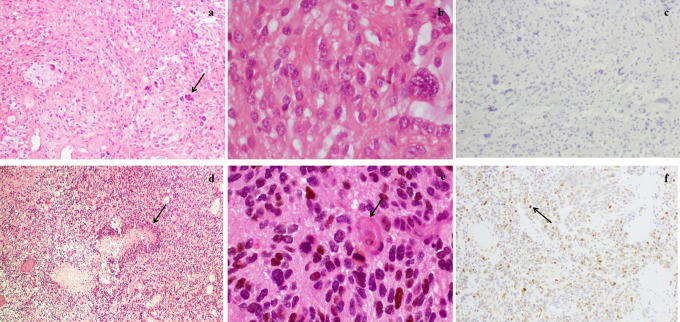
图1,组织病理学:(A)一开始手术的手术标本用苏木精-伊红(×100)染色,显示束状、粘液样区域、双较肿瘤细胞和一些巨细胞(箭头)。b、苏木精-伊红(×400)染色,无有丝分裂和核间变的细胞。c、p53免疫组化染色阴性代表结果。二次手术的手术标本用苏木精-伊红(×100)染色,显示细胞过多,有小的间变性细胞和栅栏状坏死(箭头)。e,苏木精-伊红(×400)染色,有有丝分裂(箭头)和内皮增生。f、p53免疫组化染色阳性代表结果(箭头)。
比较基因组杂交分析如所示表1。没有进行辅助治疗。手术后,临床和影像监测没有显示复发的证据。10岁时失访。五年后,他出现了3个月的间歇性头痛和呕吐史。在诊断时,他表现出意识状态改变、共济失调和子宫收缩障碍。电脑断层扫描显示右侧小脑半球有一个大的囊性病变,并伴有出血。这个肿块增强了造影并导致梗阻性脑积水(图2A和B).
表1,毛细胞性星形细胞瘤和胶质母细胞瘤的比较基因组分析的比较。


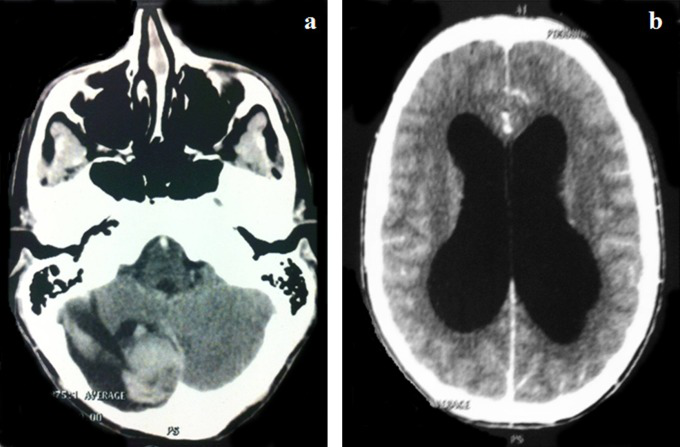
图2,轴位增强后计算机断层扫描显示毛细胞性星形细胞瘤诊断后12年局部复发。右侧囊性小脑肿瘤伴有出血成分。b、病变引起的脑积水。
患者进行了二次手术,对病变进行了大体全切除。手术和术后期间都很顺利,二次手术后的磁共振成像没有显示任何残余病变或髓质病变的迹象。与病理学相反,12年前,组织病理学发现与胶质母细胞瘤一致,显示间变性和多形性细胞、坏死、内皮增殖、Ki-67免疫染色的高增殖指数和阳性p53(超过50%的癌细胞核染色阳性;图1D-F)。
二种病变的比较基因组杂交分析显示于表1。在一或二肿瘤中均未发现BRAF基因外显子15突变。他接受了高剂量甲氨蝶呤、顺铂、依托泊苷、异环磷酰胺和长春新碱加局部放疗的辅助治疗(59.4 Gy)。治疗结束后两个月,他的核磁共振成像显示背侧软脑膜接种(图3)。
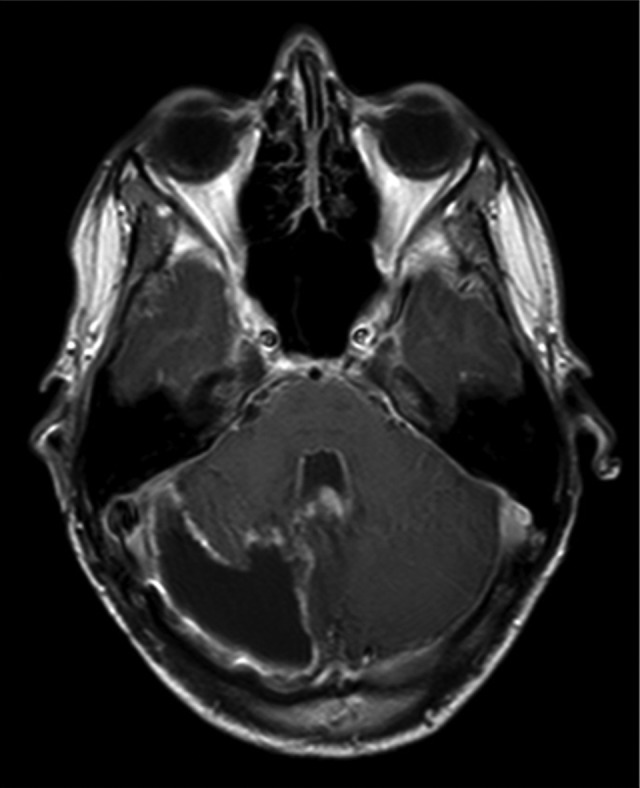
图3,辅助治疗后的轴向增强T1加权磁共振成像显示异常的软脑膜对比增强。
然后,他接受了5个疗程的替莫唑胺加对有症状的背部病变的局部放疗。在替莫唑胺的五个疗程后两个月,患者出现了神经功能的快速恶化。神经影像显示沿着脑室系统进行性颅内和脊髓软脑膜播散和出血。死于疾病进展发生在胶质母细胞瘤诊断后16个月和毛细胞性星形细胞瘤诊断后14年。
案例讨论
该病例说明了低级别胶质瘤演变为恶性胶质瘤的潜在风险。其潜在机制仍不清楚。在大多数已发表的病例报告中,患者以前接受过放疗。因此,这种疗法被认为是恶性变化的关键因素,尽管没有关于累积发病率、危险因素和分子异常的可用信息。也有报道称在没有放疗的情况下发生恶性转化,但偶尔发生在儿童时期和小脑以外的部位。
与肿瘤复发或恶性变一贯相关的因素是术前对比增强成像,其通常提示高级别神经胶质瘤,但它也可存在于15%至40%的低级别神经胶质瘤患者中;肿瘤大小,因为大小每增加1厘米,复发风险增加1.3倍;和分子异常。
一旦对比增强的程度被用作恶性肿瘤的指标,磁共振成像在检测自然病程早期的神经胶质瘤中是一种重要的诊断工具,并且没有对比增强可能提示低级别的神经胶质瘤。然而,一些非增强病变可能是恶性的。因此,放射学特征是用于评估治疗反应和结果的标准组合的一个组成部分。其他标准包括临床发现(患者年龄、神经功能状态和肿瘤位置)、手术切除范围、组织学特征、增殖指数和分子特征。
关于低级别神经胶质瘤的分子特征,鉴定了许多数值和结构异常,其中染色体7、8和17较常受到影响。然而,传统的核型分析在多项研究中没有发现,7号染色体获得了一致的发现。17p(p53位点)的缺失与疾病的快速复发有关,因为p53调节细胞周期停滞、DNA修复、凋亡、自噬、衰老、多能性控制和干细胞自我更新的控制。p53肿瘤控制基因在神经胶质瘤形成的早期经常突变或缺失。一种假设是,高级别神经胶质瘤可能会出现和复发,因为存在于受保护的小生境区域中的神经干细胞会发生恶性转化。儿童中的TP53突变限于5%至10%的经历恶性转化的低级胶质瘤。七较近,多个小组报道了在7q34区域有一个小的非随机重复,包含BRAF-KIAA1549基因融合。该基因存在于60%至80%的散发性毛细胞星形细胞瘤患者中,并与幕上位置、复发和不完全切除相关。
本病例报告是有意义的,原因如下。首先,这是对儿童小脑低级别胶质瘤自发恶性转化的一次描述。二,p53在继发性肿瘤中表达,而在前体肿瘤中不表达,这证实了p53在转化过程中的作用。毛细胞性星形细胞瘤的比较基因组杂交分析显示了这种类型肿瘤的较一致的发现,即7号染色体的获得。没有其他先前描述的分子异常被发现。由于低级别胶质瘤的特征似乎与分子和细胞生物学特征密切相关,因此需要对大量低级别胶质瘤恶变儿童进行临床、分子和结果分析,以阐明其病理生理机制。
总之,文献回顾和当前病例支持对诊断为低级别胶质瘤的患者进行长期随访的必要性。可能存在分子和生物变异,因此需要进一步的基因型研究,以评估哪些低级别胶质瘤将发展为高级别胶质瘤,并可以受益于更的辅助治疗。




