脑海绵状血管畸形(CCMs)是一种低ffow局灶性血管异常,其组织学特征是在血栓形成的不同阶段紧密堆积的薄壁血管内充满血液。复发性病灶内或病灶外(微)出血和继发性铁沉积决定了有症状的患者的临床表现,主要是癫痫发作或局灶性神经功能障碍。脑海绵状血管畸形影响约0.5%的人群,主要以散发性形式发生,较少发生,是一种遗传性常染色体显性(家族性)形式。前者通常以单个病变为特征,后者表现为多个病变,分布于整个中枢神经系统和/或其他器官系统。然而,根据CCM1/KRIT1、 CCM2/MGC4607或CCM3/PDCD10中特定的潜在种系突变、疾病外显率、患者年龄和其他因素(例如,应用MRI技术),可检测病变的数量差异很大,从单个或少数病变到数百个病变。另一方面,散发性CCM也可能表现为多发性病变(10%-15%),多达三分之二的病例出现潜在的种系突变。
由于家族性形式对疾病的自然史和治疗有影响,是与散发性形式相比,具有相当大的社会成分,因此在多发性病变患者的咨询期间尽早澄清是可取的。已知CCM1–3突变的分子筛选是较敏感的方法,但通常仅在数月到数年后开始。此外,关于潜在家族史的信息可能是零碎的,特别是因为许多CCM仍无症状。因此,多发性CCM的初始MRI诊断经常导致患者及其家人长期处于不确定状态。然而,基于怀疑参与散发性和家族性CCM形成的不同病理机制(分别在3个具有连续内皮功能障碍的CCM基因中的1个中,静脉畸形或发育性静脉异常[DVA]相关形成或功能丧失突变[种系或体细胞]),预期可检测到这些形式的多个CCM之间局部静脉血管构筑的特异性差异。这一点尚未得到系统研究。我们提出以下假设:
1)多个CCM的不同分布
2)可以检测到多个CCMs的不同相邻静脉血管构筑
3)这些将与潜在家族性疾病的遗传筛查相关。因此,我们进行了一项研究,以寻找多个CCM的高分辨率MRI中的特定模式(≥2).为了提高描绘CCM病变和相关静脉血管结构的敏感性,采用磁化率加权成像(SWI)和标准解剖成像方案,在7-T磁流体强度13下进行全磁共振成像。图像分析后,结果与包括筛查CCM1–3基因突变在内的遗传检查结果相匹配。
研究方法
这项研究是在德国杜伊斯堡-埃森大学神经外科系和欧文•L•哈恩磁共振成像研究所根据批准机构审查委员会制定的全部指南进行的。该研究是highffeldMRI高级基础研究的一部分。根据赫尔辛基宣言,在检查前获得了每位患者的知情同意。CCM1–3基因的序列分析主要在德国格雷夫斯瓦尔德大学人类遗传学系进行,部分在德国雷根斯堡大学人类遗传学中心和系进行。
患者特征
2010年至2015年间入院的全部患者均显示出多个CCM(≥2)本研究包括1.5-TMRI(对比增强T1加权、T1加权、T2加权和T2加权)和接受CCM1-3基因序列分析的患者,并使用7-TMRI进行SWI。排除基因筛查不完整的患者、怀孕患者和有颅脑辐射史的患者。在先前的研究中,对散发性疾病和孤立性病变的患者进行了分析。
根据CCM研究报告标准评估全部患者的基本临床数据和病史。在全部患者中,SWI均在7T下进行(Magnetom7T;西门子医疗保健公司)。磁化率加权成像序列是在以前的工作中建立的。全身高ffeldMR系统配备了单通道发射器/32通道接收器头部线圈(NovaMedical),以及较大振幅为45mT/m、转换速率为220mT/m/msec的梯度系统。SWI参数如下:TE15毫秒,TR27毫秒,ffip角度(FA)14,平面内分辨率(R)250m、切片厚度(ST)为1.5mm,带宽为140Hz/像素。将SWI数据处理为相位、幅度、磁化率和较小强度投影图像。此外,解剖T1加权(TR2500毫秒,TE1.4毫秒,FA6,0.7mm各向同性),T2加权(TR6000毫秒,TE99毫秒,FA29,ST为3mm,R为0.5mm2)和荧光血管造影时间(TR为20msec,TE为4.3ms,FA为20,ST0.4mm、R0.2mm2)序列。
图像分析
全部7-TMR图像(相位、幅度、SWI、T1加权和T2加权)均由2名具有SWI分析经验的观察者使用内部工作站进行分析。评估了以下标准:CCM的数量、位置、类型和大小(≥超过或不超过10mm的1cm)。使用轴向平面T2加权涡轮自旋回波确定尺寸。此外,分布超过1、2或3≥确定了大脑的3个区域(额叶、颞叶、枕叶、顶叶、岛叶、基底神经节、脑干和小脑)。超过2个脑区的分布被定义为多灶分布。在患有CCMs的大脑区域,检查局部静脉血管构筑是否存在典型的DVA或先前指定的解剖异常,是否存在经大脑髓质静脉或静脉根的形成。在确认DVA的情况下,收集静脉的数量和狭窄(血管直径减少>50%)或成角路线(<90角度)进行评估。发育性静脉异常分别根据2个、较多4个或>4个静脉系统节段的受累程度分为小型、中型或大型。用作生理参考的静脉系统分类如表1所示。易感性加权和图像时间相关,以区分动静脉血管和静脉血管,例如动脉化静脉畸形。在一组1.5T的SW图像可用的患者中(n=25),评估以下标准并与7-TMRI的ffndings进行比较:1)CCM数量,2)是否存在DVA。

分子遗传学分析
有学者在知情同意的情况下对患有CCMs的个体进行桑格测序分析。随后使用多重连接依赖性探针扩增筛选突变阴性个体的CCM1-3大改变。GenBank和ENSEMBL的登录号如下:CCM1,序列在SeqPilot中用ENSEMBL数据集进行分析。DNA突变编号基于cDNA序列,其中+1对应于ATG翻译起始密码子的A。
统计分析
使用SPSS统计版本22(IBMCorp.)进行统计分析。区间标度数据表示为均值和标准差,标称数据表示为数和合适百分比。组间比较采用分类变量的Fisher精确检验和连续变量的Mann-WhitneyU检验。为了根据我们样本的MRI数据估计评估家族性或散发性疾病的长期概率,应用了规则3(95%CI)。
研究结果
28名患者(15名女性和13名男性),平均年龄42.7岁研究包括12.9年(19-64岁)(表2和表3)。2010年至2015年间出现多个CCM的另外六名患者不符合资格标准。对全部28例患者进行了基因序列分析。两名患者是已知CCM3突变家族的兄弟(病例4和8;表3),另外两名患者为已知CCM2突变家族的母女(病例2和13)。24名患者至少出现1例症状性出血,其中4名患者患有海绵状血管瘤相关癫痫。4名患者无症状。


图像分析
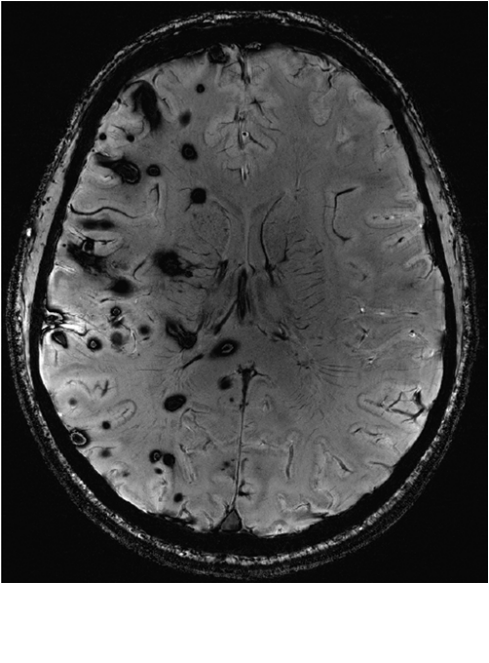
在7-TSWI时,CCM的总数为681,平均数为22.440.0(范围2-153)。17例出现多灶分布。在11例患者中发现CCMs与典型的DVA相关。未检测到与局部静脉异常相关的其他CCM。在16例患者中,至少有1例CCM超过10mm。根据Zabramski分类,19例患者(33例CCM)中发现了Ia/b型,14例患者(30例CCM),2例患者(4例CCM中)发现了III型,1例患者发现了IV型。613个病灶仅在SWI上可见小信号消除。病灶内或病灶外大出血(>10mm)9例。发育性静脉异常显示2.51.9(范围1-7)收集静脉。在9例DVAs中证实了狭窄,9例DVA中证实了集合静脉的成角走行。8个被归类为大型,3个为中型。进一步的细节如表4所示。根据MRI标准,患者被分为两组:(多)无相关DVA的病灶分布(分散型;图1)和相关DVA(簇型;图2)。有关详细信息,请参见表2和表3。图3中提供了模式示意图。在1.5-TSWI(n=25)下,检测到的CCM总数低于7-TMRI(平均33.241.3对39.849.2个病灶)。6例患者中检出的病变较少。两种成像方式的DVA检出率相似。




分子遗传分析
Sanger测序和MLPA显示15名患者中存在CCM1–3突变,其中6名患者没有家族史。然而,这6人中有1人从母亲那里继承了突变,她母亲在52岁时被发现患有6例无症状CCM。在13例既往无家族史的患者中,Sanger测序和MLPA未发现突变。详情见表2和表3。
在任何情况下,簇型MRI模式与CCM1–3的阳性分子筛选无关。17例中15例的分散型MRI表现为阳性基因筛查。这种差异具有统计学意义(Fisher精确检验,p<0.0001)。集群型组的CCM总数低于随机型组(4.71.5对33.848.5;Mann-WhitneyU检验,p=0.07)。其他分类变量(出血量>10mm和CCM类型)无差异。根据规则3,仅从统计学角度来看,根据我们样本的MRI数据评估散发性疾病与家族性疾病的长期失败概率约为10.7%(95%可信区间)。
讨论
在本研究中,多发性CCM的MRI模式在疑似散发性(阴性基因筛查)和家族性(阳性基因筛查)疾病形式之间明显不同。疑似散发性CCM的疾病分布仅限于大脑的1或2个区域,多灶性DVA患者除外(病例1和11;表2)。在Confrmed家族性疾病中,CCM分布在大脑的多个区域,除了2例仅出现少数病变(分别为2和4个CCM)(病例2和7;表3)。因此,总的来说,与家族性病例相比,散发性病例中发现的病变较少。然而,一半患有家族性疾病的患者显示病变负荷<10CCMs。较重要的是,CCM位于集合静脉引流区的典型DVA与全部病例的阴性基因筛查相关,表明为散发性疾病。在全部Confrmed家族病例中均未发现相关的典型DVA或局部静脉异常。这些差异具有统计学意义。两组之间显示急性出血的病变数量(Ia和Ib型与II、III和IV型相比)或病变大小没有差异。基于脑内分布的重复模式以及与DVA的关联/不关联,我们建议将模式命名为集群型(散发型)和分散型(家族型)。
我们的结果表明,在集群型分布的患者中,潜在家族性疾病的存在是较不可能的。另一方面,分散型分布提示家族性疾病。然而,在2例分散型MRI中,常规基因筛查CCM1-3突变阴性,且家族史阴性。有趣的是,其中一名患者(病例9;表2)显示了仅局限于一个半球的多个CCM的异常模式(图4)。这种分布模式相当可能暗示潜在的体细胞突变。体细胞突变发生在发育过程中,并在随后的组织中繁殖。较近,McDonald等人在一个类似的案例中报告了体细胞镶嵌的证据。
然而,对于分散型MRI患者,种系突变的诊断需要基因分析。如今,这种分析识别了越来越多已经发表的突变,但也很少受到诊断缺口的阻碍。这些差异可能是由于存在未检测到的嵌合体、额外的四个CCM基因、16或深度内含子突变,这些突变可能激活替代或隐蔽剪接位点。这些技术限制通常被认为是导致潜在突变尚未被发现的原因。我们将病例17的阴性基因筛查(表3)归因于此类诊断缺口。在我们部门,我们仍然普遍建议对多发性CCM患者进行基因筛查,是年轻患者或有症状亲属的家庭。另一方面,如果显示簇型MRI模式,我们已经告知患者家族性疾病的概率较低。在散发性和家族性病例中,DVA与多个CCM的相关性以前已有报道。Mondéjar等人在西班牙和葡萄牙的一系列家族性和散发性病例中筛查了致病性突变,其中包括4例出现多个CCM并伴有DVA的病例。这些基因中没有一个携带CCM基因的致病性突变。Petersen等人的MRI研究也报道了家族性病例中DVA的非关联性。
该系列仅包括CCM1/KRIT1突变的家族(并非全部患者都可进行基因筛查),汇编了单发和多发病变,未提供SWI或进一步的MRI模式分析。与临床常规成像(T2加权)相比,磁化率加权成像,是在使用高ffeld强度MRI进行时,对CCM病变和DVA更为敏感,并且可以在亚毫米分辨率下应用。这将丢失任何血管损伤的可能性降至较低。然而,在本研究中,相关的MRI数据(DVA的检测和CCM病变的检测)在1.5-T和7-TMRI之间没有显着差异,这表明在大多数情况下,常规临床方案可以提供该信息(至少对于本研究中发现的大或中型DVA;在较低的ffeld强度下可能会遗漏细微的DVA)。
SWI检测DVAs的一个明显优势是不需要外源性造影剂。较后,我们的ffndings(集群型模式)支持先前的假设,即DVA可能与零星CCM的形成有关,这是从它们的系统发生和密切的地形关系判断的。在DVA排水区域附近存在各种新的CCM形成的报告。此外,我们自己的研究小组在一系列连续的散发性(主要是孤立性)病变中发现了CCM和DVA的系统相关性。这些发现表明散发性和家族性CCM的发病机制不同。Awad等人在其出血性血管生成增殖假说中对此进行了更详细的讨论。根据这一假设,DVA内的结构和血流动力学条件是致病因素。事实上,在这一系列研究中,我们可以确认DVA(引流静脉狭窄和成角度走行)的特定血管构筑因素的存在,这些因素被认为与并发CCM的形成有关。
相反,家族性CCM源于CCM1–3中的功能缺失突变导致的系统性内皮功能障碍;较常见的形式(CCM1/KRIT1)涉及RhoA和Rho激酶系统。因此,影响该系统的药物治疗(家族性病例的建议未来治疗选择)可能不适用于更常见的散发病例。我们的研究一次对多个CCM患者的前瞻性连续系列进行了高分辨率SWI与基因筛查相结合的研究。主要研究限制是样本量相对较小。然而,多个CCM很少见,仅占全部CCM的15%,这通常会导致小系列。
结论
我们的结果表明,多个CCM与该疾病散发形式的DVA存在系统关联。如果在MRI上诊断出这种簇型模式,那么家族性疾病及其严重的临床意义似乎不大可能。这在患者咨询中具有高度相关性。特别是当与常规基因筛查相结合时,这些特异性MRI模式的存在可能进一步确保诊断多发性CCM患者的家族性或散发性疾病。较后,我们的结果与DVA是(1种形式)散发性CCM形成原因的理论一致,这对疾病的自然史和治疗有影响。




