脑海绵状血管瘤是较常见的脑血管畸形,发病率为0.4-0.5%主要为20-40岁的男性,儿童占25%。脑干海绵状血管瘤很少见(18%),其出血率高于幕上海绵状血管瘤;它们在脑桥中更常见(61%),估计每年出血率为2-6.6%。在儿科人群中,病变位于桥脑(73%),每年出血率为12.3%,每年再出血率为32.5%。
有一种常染色体显性遗传关系,与CCM1基因(脑海绵状血管畸形1)、CCM2和CCM3相关。CCM1位于7号染色体7q11.2-q21带,CCM2位于7p15-p13带,CCM3位于3号染色体3q带;40%位于突变1,20%位于突变2。当与家族遗传有关时,多发性海绵状血管瘤的几率更高,出血率也更高。
通过磁共振成像和临床表现进行诊断;较常见的症状是出血、癫痫发作、凝视麻痹、复视、阻塞性睡眠呼吸暂停、垂直和扭转眼球运动、步态障碍、头痛和局灶性缺损。海绵状血管瘤也可以被意外诊断。每年出血的风险在5%到6.6%之间,再出血的风险在26%到30%之间。因此,治疗应始终在成人中进行。在儿科人群中,适应症包括多发性出血、等于或大于2厘米的病变、严重或进行性缺损、外生性病变和脑干的肿块效应。
相关阅读:德国巴特朗菲教授20余年231例脑干海绵状血管瘤手术结果分析
桥脑海绵状血管瘤怎么治疗?
选择的治疗方法是手术,出血后4-6周,尽管时间仍有争议,因为在血肿尚未形成的时期手术更容易;在这种情况下,目标是完全切除,防止出血复发和功能恶化。然而,在指示外科手术之前,需排除主要的鉴别诊断(脑桥胶质瘤和多发性硬化)。
位于脑桥上的脑干海绵状血管瘤分为背侧、外侧和腹外侧。由于皮质脊髓束损伤和术后缺损恶化的风险,进入脑桥前部是危险的。由于脑桥腹内侧区的皮质脊髓束,前外侧入路已用于腹内侧病变。研究发现83例桥脑腹外侧区海绵状血管瘤患者大多选择乙状窦后入路。

表1:脑桥腹外侧区的手术入路
Gross等人对1390例患者进行荟萃分析,总切除率为91%,死亡率为1.5%。同一作者对683名患者进行的另一项荟萃分析显示,14%的患者神经功能缺损恶化,死亡率为1.9%。在一个分析中,观察到脑干前部海绵体瘤的以下入路:乙状窦后、经岩前部(Kawase)和乙状窦前/迷路后。
海绵体瘤或血肿的大小与手术成功无关,血肿有助于剥离;然而,当再次出血时,由于纤维包膜的形成,剥离困难。脑桥前外侧部的进入区在顺利区,在腹内侧区外侧1cm处,朝向V神经根,大约1cm大小;需使用这种方法来减少缺陷。
经典的乙状窦后入路(图1)显示脑桥的腹侧部分是一种局限性;这种方法的延伸是一种替代方法,切除一部分乳突骨和颞骨,并增加50%的视角,这就允许腹侧入路伴小脑下段牵引力。后腿EF等人。描述了9例乙状窦前入路(图2),可进入桥外侧部,面神经和三叉神经之间,垂直于脑干。
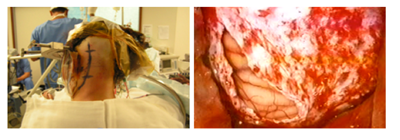
B:左侧乙状窦旁的硬脑膜开口。

D: 小脑幕打开。
颞下经小脑幕入路治疗桥脑顶部海绵状血管瘤,经颅中窝入路,颞叶回缩,小脑幕切开,但须经静脉神经识别。
前路经岩骨入路(Kawase入路)适用于位于桥下段的病变,可通过中窝进入,广泛解剖,钻取岩尖,打开幕,可见岩上窦。彭虎等。在9.6%的病例中使用这种方法,Alba等人在5%的病例中使用这种方法。
远外侧入路(图3)适用于脑桥前部下斜坡的病变;作为一个优势,它显示小脑和脑干的回缩较小。然而,这种方法需要长时间的手术,并可能导致颅颈不稳和椎动脉病变。经口入路(图4)是桥脑下部病变的另一种选择。

B: 左枕髁钻孔解剖。
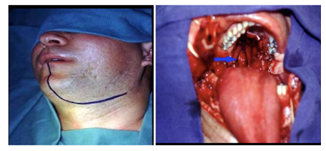
B: 斜坡前部的开口。
对于脑桥腹内侧区的海绵状血管瘤,内鼻-经鼻入路是可行的,因为它可以直接进入并减少大脑组织的操作,从而减少术后的发病率和住院时间(图5)。这种方法的并发症是脑脊液漏的风险,尽管可以通过腰椎引流和小骨将其较小化缺陷内镜检查需要很强的手术能力和足够的工具;外科医生需经过培训,设备需可用。Kassan等人将内镜病变的复杂程度从I到V分为V型;桥前海绵体瘤有V型。
术后再出血与残余海绵体瘤有关;然而,无症状残留病变的存在并不能证明新的外科手术是合理的。
放射外科不是优选治疗方法,因为在治疗潜伏期有14%至40%的出血风险,其并发症与所用的放射剂量直接相关。这是被认为不能切除的病变的替代方法,需进行观察。
神经内镜检查、神经生理监测、牵引成像、术中超声和神经导航现在有用。扩散张量成像(DTI)追踪成像显示了皮质脊髓束的移位,并且可以促进外科手术。在解剖和切除病变过程中的神经生理学监测对于皮质脊髓束病变的监测有用。
桥脑海绵状血管瘤怎么治疗?前脑桥海绵状血管瘤出血风险高,再出血风险较高;因此,由于发病率和死亡率的,他们需在确诊后立即接受治疗。治疗是通过外科手术进行的,并且需根据脑桥上部和下部的地形图以及神经外科医生使用内镜的能力来选择手术方法。需始终瞄准肿瘤的完全切除和治愈。




