胶质瘤是什么病?脑胶质瘤的年发病率为3~6.4/10万,约占全部中枢神经系统肿瘤的23.3%,约占恶性肿瘤的78.3%;其中国际卫生组织(World Health Organization,WHO)4级的胶质母细胞瘤(glioblastoma,GBM)年发病率较高,约为4.03/10万,占原发恶性脑肿瘤的48.6%[1]。胶质瘤恶性程度高,综合治疗后患者预后仍较差,近期研究显示胶质母细胞瘤已超过胰腺癌和肝癌成为一难治肿瘤。2002年之前,GBM患者诊断后的中位总生存期(median overall survival,mOS)少于1年,5年生存率低于3%;随着STUPP方案的应用,GBM患者的mOS提升至16个月,中位无进展生存期(median progression-free survival,mPFS)为6.9个月;自2016年起,应用STUPP方案联合肿瘤治疗电场(tumor treating field,TTF)后,患者的mOS可延长至20.9个月。
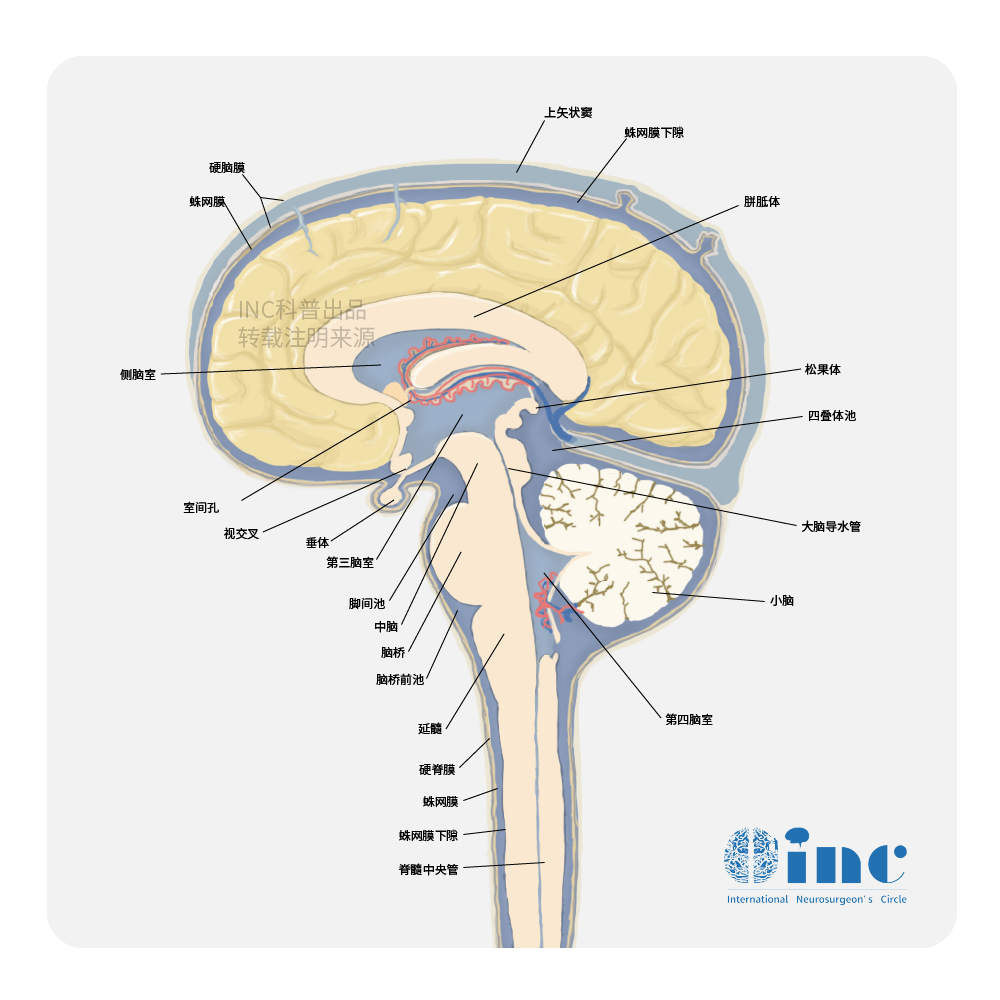
胶质瘤的手术原则是较大范围顺利切除肿瘤
胶质瘤的手术原则是较大范围顺利切除肿瘤,进一步细致化胶质瘤外科手术治疗是神经外科医生关注的重中之重。中国医师协会脑胶质瘤委员会、中国抗癌协会脑胶质瘤委员会及中国脑胶质瘤协作组共同制定了《成人丘脑胶质瘤手术治疗中国专家共识》。同时,基于手术患者队列探讨了成人新诊断丘脑胶质瘤的临床评估模型,并完成了在线预后评估工具的建立。
胶质瘤的切除边界是神经外科医生面临的较大问题。随着对胶质瘤分子病理的认识加深,研究者发现在特定的分子亚型中广泛切除并不能好转患者预后。江涛教授团队基于CGGA数据库进行的回顾性研究显示,年龄>45岁、术前KPS>80分及IDH突变的星形细胞瘤患者可从肿瘤全切中获益,但IDH野生型和少突胶质细胞瘤患者未从肿瘤全切中得到生存获益。
这一结论可能改变胶质瘤的手术理念:从“较大范围的顺利切除”至“合适的顺利切除”。此外,华山医院团队牵头联合美国加州大学旧金山分校、法国居伊·德·肖利亚克医院开展了一项国际多中心研究,通过唤醒麻醉下的术中直接电刺激绘制了较大样本量的术中电刺激语言皮质功能图谱,确定了人类较小共同语言皮层。这一研究成果对于进一步理解语言的组织和产生意义,同时为临床神经外科手术提供了语言定位和保护的图谱
这一结论可能改变胶质瘤的手术理念:从“较大范围的顺利切除”至“合适的顺利切除”。此外,华山医院团队牵头联合美国加州大学旧金山分校、法国居伊·德·肖利亚克医院开展了一项国际多中心研究,通过唤醒麻醉下的术中直接电刺激绘制了较大样本量的术中电刺激语言皮质功能图谱,确定了人类较小共同语言皮层。这一研究成果对于进一步理解语言的组织和产生意义,同时为临床神经外科手术提供了语言定位和保护的图谱
除影像学技术指导外,目前对术中荧光剂应用的重视程度也逐渐上升。5-氨基酮戊酸作为术中荧光成像剂相继在欧洲和美国获批,但其在低级别胶质瘤的显像方面作用不大。因此,开发高选择性、低毒性、给药方式简单的荧光探针成为未来可行的研究方向,可通过靶向肿瘤特异性配体提高选择性,其中EGFR成为较有潜力的靶点。
新靶点探索、新药研发及靶向治疗研究
目前,胶质瘤的治疗方案为包括手术治疗、放疗、化疗、靶向治疗、免疫治疗等在内的综合治疗方式,但鲜有治疗方式可好转脑胶质瘤患者的预后。因此,探索新的治疗方案意义,而探究新的治疗靶点及新的靶向治疗药物已成为研究者关注的焦点。
MET基因融合突变可激活MAPK信号通路,损害细胞周期调控,进而诱导肿瘤进展,既往研究提示MET控制剂在动物模型中可控制肿瘤生长。江涛教授带领的脑胶质瘤准确咨询创新团队通过自建中国人群脑胶质瘤数据库,识别胶质瘤治疗靶点PTPRZ1-MET融合基因,研发了单靶点小分子化合物伯瑞替尼,并在动物模型和患者层面探索了其在胶质瘤靶向治疗中的应用,研究成果以亮点文章发表于Cell。同年发表于Lancet Oncology的研究发现,靶向BRAF的达拉非尼与靶向MEK的曲美替尼的联合靶向治疗,在携带BRAFV600E突变的难治性/复发性高级别胶质瘤以及低级别胶质瘤患者中均具有临床意义]。
抗血管靶向药物可控制脑胶质瘤生长和血管源性脑水肿。牟永告教授团队通过回顾性研究指出,多靶点抗血管生成剂安罗替尼单独使用或与替莫唑胺联合均对复发性高级别胶质瘤患者表现出令人鼓舞的疗效和良好的耐受性。
随着脑胶质瘤分子病理分型的逐步推进,新靶点的探索、新型靶向药物的研发及临床试验已成为研究的焦点,如抗血管生成靶向药物贝伐单抗、瑞戈非尼及安罗替尼、作用于MET融合基因的伯瑞替尼及奥纳妥珠单抗、作用于BRAFV600E突变的达拉非尼和维莫非尼等。目前,李文斌教授团队正开展十余项针对胶质瘤新药的临床试验,研究药物包括绿原酸、和厚朴酚脂质体、TJ107、靶向PI3K/AKT通路的ACT001及靶向CD95配体的靶向单抗药物CAN008。上述药物在机制方面均已有较为完善的研究,且绿原酸已进入Ⅱ期临床试验,结果令人期待。
此外,我国多家单位的多位专家参与了国际多中心临床试验“脑胶质瘤适应证临床创新试验体系”(glioblastoma adaptive global innovative learning environment,GBM AGILE)。GBM AGILE项目通过多组贝叶斯适应性随机平台试验,在同一临床试验中检验多种治疗方法的合适性。相较于传统的单组新药合适性临床试验,该研究方法可更高效地进行合适性验证,并灵活调整试验组,增加分配至合适治疗组的病例数量。目前,试验组药物已纳入瑞戈非尼、Paxalisib及VAL-083,期待更多的潜力药物加入GBM AGILE项目。
在2021年研究的基础上,未来的研究方向还包括靶向治疗的给药方案及方式。研究提示,新辅助治疗可在程度上好转肿瘤微环境,增强治疗效果,进而提升患者预后。贝伐单抗等抗血管生成药物可好转肿瘤血液灌注,促进肿瘤血管正常化,故针对靶向药物的新辅助治疗等给药方案有望进一步加强药物治疗的输送并好转治疗效果。同时,利用药物递送纳米材料靶向药物递送,以提高靶向药物至颅内的递送效率并较小化其不良反应,也可能是加强靶向药物治疗效果的方向。




