选择进入和接近任何脑干损伤是较困难的外科决定之一。一般来说,手术只对局灶性、外生性或颈髓性肿瘤有益。手术应获得足够的组织进行组织学分析。手术的目的是完全切除时,判断这是顺利的影像学术前。如果这是不可行的,那么目标是尽可能顺利地减少肿瘤负荷。手术的成功部分与肿瘤生物学有关。已经描述了顺利进入区域,例如上方三角形或下方三角形(图1);脑干的内在肿瘤可能扭曲正常的解剖结构,因此模糊了通常的标志。一般来说,为避免对神经组织造成长期性损伤,入路不应具有侵略性。手术的主要目的是完全切除肿瘤,这可以通过优化暴露和选择风险较小,因此更顺利的方法来实现。1不仅要了解显微外科解剖,而且要了解病变所在的脑干位置的功能。在切除过程中,运动诱发电位除四心室底测图外,还可用于提供反馈。这篇文章是一篇讨论脑干胶质瘤诊断、成像和分类的文章的延续。本文将介绍脑干肿瘤的手术入路,以及相关的神经导航、神经生理监测和术中成像技术,以帮助这些手术的顺利进行。

图1:A) 四脑室底背视图。此图显示了面上(SF)和面下(IF)三角形。右侧的插图列显示了B)上部、C)中部和D)下部桥臂的相应轴截面。
神经导航
在过去的20年里,立体定向引导和现在更普遍的无框架神经导航(图2A,图3)正越来越多地被许多神经外科医生用于脑肿瘤手术,是在复杂和复杂的大脑区域。主要目的是准确定位病变,帮助避免大脑中重要的功能和血管结构。在脑干手术中,神经导航有助于定位病变,特别是当病变部分被正常大脑覆盖并推动脑干核团时。更重要的是,在手术过程中,可以使用预先获得的扩散张量成像和白质纤维束成像信息进行神经导航(图2D)。当试图勾勒出与脑干连接处的病变时,是考虑到白质束通常因病变而变形或偏离正常解剖位置时,这一点有用。神经外科医师在神经导航术中经常面临的警告是脑脊液(CSF)丢失和肿瘤切除和回缩时出现的脑移位和变形现象。这可以通过术中成像(如超声、术中CT或MRI)的出现而克服。

图2:一些可用技术A)术中磁共振成像设备。B) 病人头部俯卧位,通过磁共振线圈内显示的螺旋线圈iOM电较连接。C) 手术开始后,病人,iOM工作人员和设备连接(箭头)。D) 纤维束造影显示肿瘤移位的神经束(虚线箭头)。iMRI-术中MRI设备,NN-神经导航设备和屏幕,吸顶显微镜,iOM-术中神经生理监测

图3:插图描绘后颅窝,显示延髓肿瘤的轨迹(箭头),由艺术家绘制A)和神经导航截图B)。图示为神经导航探头(绿杆)、三神经(III)、中脑(MB)、桥脑(P)、延髓(MO)、脊髓(SC)斜坡(CL)、小脑扁桃体(CT)、齿状突、天幕(T)、窦汇(C)、颈椎1号(C1)、颈椎2号(C2)、齿状突(O)的位置
术中磁共振成像
iMRI是神经外科较有帮助的较新进展之一(图2A)。在脑干肿瘤手术中,通常肿瘤的确切边界并不清楚,脑干结构过于珍贵,除非能看到正常组织,否则无法尝试切除,是在肿瘤组织与正常大脑相似且有反应性胶质增生的情况下。在这些病例中,iMRI有助于获得新的图像来验证切除的范围,并决定是否需要更多的手术。在一项包括127名患者的研究中,随着手术过程中解剖结构的改变,联合应用iMRI和神经导航(图2A)使得手术更加顺利。在手术过程中对肿瘤进行可视化,可以更精确地切除肿瘤,并且可以立即评估手术结果。这种结合有助于纠正手术操作中的脑移位,并较大限度地减少术后神经功能缺损。
术中神经生理监测(iOM)
脑干手术已得到好转,并因iOM的进展而变得相对顺利(图2B和2C)。iOM分为监测穿过脑干的传入和传出长束的完整性的模式、监测脑干颅神经(CN)核完整性的模式,以及那些通过映射帮助定位CN核以避免他们。那个神经生理学测试的目的是降低手术中脑干操作固有的风险。对中枢神经核功能的监测提醒外科医生任何即将发生的情况损伤。术中监测包括脑电图、脑干听觉诱发电位(BAEPs)、运动诱发电位(MEP)、体感诱发电位(SEP)、神经传导、肌电图(EMG)和脑干标测(BSM)。在现有的iOM技术中,BSM和皮质脑干束运动诱发电位监测(CBT-MEP)是脑干胶质瘤手术中较有用的方法。
BSM也被称为功能标测或四脑室底标测,可以在介入治疗前帮助定位CN核团,合适地为手术入路创建地图。通常在麻醉诱导和脑电图针连接后立即使用。在BSM期间,通常用于记录肌肉活动的肌肉是七脑运动核(CMN)的口轮匝肌和眼轮匝肌、用于CMN IX/X的咽后壁和用于CMN XII的固有舌肌。环甲肌或声带肌也可用于cmnx。然后使用单较探针刺激感兴趣的点。在获得肌肉反应后,刺激强度应降低到能够精确定位CMN的阈值。BSM被发现能够合适地帮助避免CMN的手术损伤,即使通常的标志物由于脑干胶质瘤的存在而缺失或扭曲。然而,BSM有几个缺点,包括手术过程经常中断,由于只覆盖CMN和传出纤维而缺少传入纤维的代表性,其应用局限于背侧脑干和四脑室,在腹侧或侧脑干手术中的应用有限,事实上,它只反映了脑干的非连续性、间歇性状态。
另一方面,CBT-MEP在整个神经外科干预过程中持续监测神经组织的完整性。头皮刺激点与标准MEP监测中使用的刺激点相同,而记录肌肉与用于BSM的刺激点相同。CBT-MEP还需要与BSM技术相同的准备程序。与BSM相比,CBT-MEP可用于任何脑干手术,包括腹侧或侧位手术。CBT-MEP的另一个重要优点是它可以在整个手术过程中连续使用,而不需要中断手术过程。皮质球束(CBT)解剖学的细节还没有很好的定义,但是Krieg等人和其他一些基于磁共振的报告已经研究了这个解剖结构,并记录了有希望的结果。术中CBT-MEP仍缺乏监测感觉传入纤维或下运动核团的能力,这就解释了尽管术中CBT-MEP完全正常,但患者仍会出现吞咽困难和构音障碍。
神经生理学检查的应用因手术部位(即中脑、脑桥或延髓)而异。对于中脑和松果体区肿瘤,动眼神经和滑车核的BSM是有帮助的。尽管CBT-MEP是一项相对较新的技术,但它对中脑病变,特别是经颞下途径接近的病变有帮助。由于脑桥肿瘤容易移位面神经核,因此应监测脑桥肿瘤的肌电图反应,这与术后功能保存密切相关。对于髓性肿瘤,手术前应进行初始BSM检查,但也应在整个手术过程中间歇性重复,是如果较初的BSM不能明确定位。BSM读数的解释应仔细评估,因为BSM可能并不表示传入通路的功能保留,是脑干下核团的功能保留。因此,CBT-MEP和BSM的联合应用对术中脑干功能的保存重要。在整个手术过程中,外科医生、神经生理学专家和麻醉师之间的协作与合作关系至关重要。神经监护期间的神经麻醉包括异丙酚和芬太尼复合静脉麻醉输注,并微调七氟醚。
术中神经生理监测与术中MRI的结合
术中神经监测与影像学相结合是一种只有少数机构才有的新技术。国家神经科学中心的研究小组在2009年一次报道了在术中使用高场MRI和术中神经生理学监测来切除脑干胶质瘤病变。这种组合是有用的,有望帮助实现更精确、更顺利的脑干肿瘤手术,切除范围更大。需注意的一点是需要使用与MRI兼容的神经生理监测电较,或者每次进行MRI检查时都需将其移除并更换;这可能有点困难,是当患者完全覆盖时。
清醒开颅术治疗脑干胶质瘤
虽然清醒开颅脑干胶质瘤手术似乎是检测和预防神经系统并发症的理想方法,但手术的位置和长度使这项任务具有挑战性。这可用于脑干活检或更短的去毛刺程序。
患者定位和脑干暴露
几乎全部可手术切除的脑干胶质瘤都位于背侧,因此应通过后颅窝入路。在大多数情况下,患者被放置在俯卧位而不是坐位(图2B),原因很多,包括降低静脉空气栓塞的风险。一种常见的做法是在应用前肩支撑的同时,将颈部略微弯曲的患者放置在适当的位置。另一种可能用于此类肿瘤的体位是坐姿,这种方法与脑静脉气栓塞的关系比俯卧位更常见,另一方面也可能与外科医生手臂疲劳有关,它提供了更多的可见性,而不需要收回。那里没有证据表明由于固有风险,应该放弃坐姿。选择正确的入路需基于有关肿瘤位置和生长模式的神经解剖学和功能数据,以及手术团队对入路和患者体位的熟悉和经验(图4)。
但半坐位具有相对优势不可忽略,目前在欧洲德国比较常见,但其对麻醉团队、手术团队、硬件设施都提出了较高要求,从全国际角度来看,利用此体位手术的神经外科医院并不多。而德国INI国际神经科学研究所对这个体位的摆放和麻醉团队的配合得熟练和擅长,更会熟练处理由于这个体位导致的术中状况。对此,国际神经外科联合会(WFNS)教育委员会现任主席巴特朗菲教授很有发言权,在2020年新版的书《Surgery of the Brainstem》的章节adult brainstem glioma中明确提出半坐位的手术体位有很多优点,适用于年轻患者。但在60岁以上的患者中,特别是当患者合并有脑积水时,半坐位可能会导致手术期间脑脊液的过度流失,因此应谨慎使用,或常规地将患者置于俯卧位。
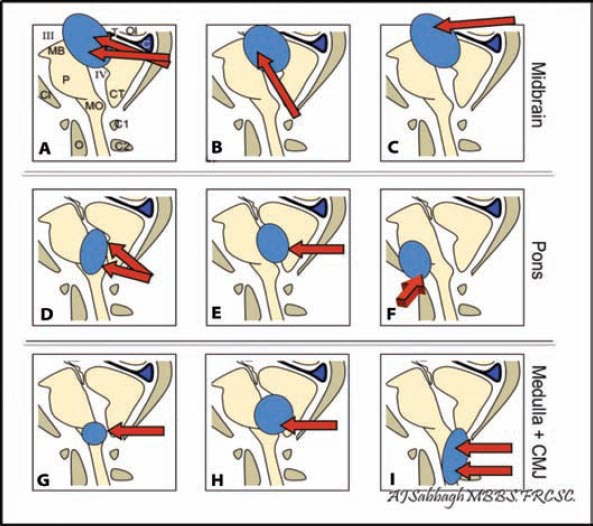
图4:显示了一些根据区域和位置的脑干示例方法的图解。顶盖区入路(A,B,C):A)幕下小脑上入路,B)经四脑室入路,C)枕部经小脑幕入路。桥区入路(D、E和F):D)远侧桥骨入路,E)经颅/近侧入路,以及F)经岩骨入路(用于前外侧病变)入路。颈髓区入路(G,H,I):G)近面,H)Telovelotonsillar,和I)颈部入路。图示三神经(III)、中脑(MB)、桥(P)、延髓(MO)、脊髓(SC)、斜坡(CL)、小脑扁桃体(CT)、齿状突、天幕(T)和窦汇(C)。
手术入路
以下将根据脑干肿瘤的位置讨论手术入路。一些方法的说明如图4所示。
中脑胶质瘤
几乎全部中脑胶质瘤都是局限性良性星形细胞瘤,起源于中脑被盖或顶盖板。小的顶盖区肿瘤可以进行连续的MRI扫描,而脑积水患者的上中脑肿瘤通常采用三脑室造瘘术。然而,由于肿块效应和邻近的解剖结构压迫等原因,有些肿瘤会进展并需要开放手术。顶盖(中脑背侧)的肿瘤主要是通过标准的幕下小脑上入路(图4A)暴露背侧切口进入的,Krause首先描述了这个方法,然后由Stein推广用于松果体区域的肿瘤。向导水管和四脑室外生的顶盖或被盖肿瘤可通过近侧入路到达,是在四脑室扩张的情况下(图4B)。这里的困难是需要的颈部屈曲,这可能会阻碍颈部静脉回流,导致更多出血。其他松果体区入路,如幕上枕骨经幕入路(图4C),取决于肿瘤的位置和邻近结构的生长方向。需要充分和顺利地暴露顶盖,以防止眼和听觉功能的损害,因为这些损害表现在顶盖。这可以通过放置一个牵开器来实现,在仔细解剖脑膜后,将小脑前上表面稍微向下移位。
正中腹侧面胶质瘤的手术入路由Yasargil等人描述的标准翼点经外侧裂入路,通过一个相当顺利的小矩形区域将运动束从手术区域中分离出来。对于累及中脑前外侧区的肿瘤,中脑外侧沟是较顺利的进入区。然而,颞下经幕入路可以进行,这通常涉及到分裂幕切迹,但有损伤唇静脉的风险。
桥脑
脑桥是全部脑干手术中较具挑战性的部位。术后并发症风险较高。位于桥背侧和上髓质的肿瘤可通过中线枕下开颅术(图4D,4E)和经四脑室入路,如Bricolo和Turazzi所述。可获得四脑室菱形窝。外生性肿瘤通过抬高和分裂小脑扁桃体和蚓部而暴露出来,而不需要过度牵引小脑半球,避免切除蚓部。小脑后下动脉侧向移位。一旦脉络膜末端暴露,就在两侧的带绦虫处横向和斜向切开。手术显微镜的角度可以提供四脑室底的完整视图。
三叉神经周围区被认为是一个更顺利的进入区,当接近前外侧病变脑桥。肿瘤累及桥小脑角区腹侧桥的手术可以通过标准的乙状窦后外侧入路,通过枕下外侧乳突后颅骨切除术,类似于听神经瘤外科手术。利用人字缝和颞侧鳞状缝合法形成的星号作为骨切除的标志,横窦和乙状窦之间的交界处被用作硬脑膜开放的指南。膨大的脑桥通过伸展的五、七和八中枢神经系统之间的裂隙进入,肿瘤被切开,注意CN V、CN VII和CN VIII。
局灶性脑桥腹外侧肿瘤少见,可通过岩骨联合入路(图4F)到达,该入路结合颞下和经幕的乙状窦前径路,该入路具有距离短、直视前外侧脑干的优点。
延髓与颈髓交界处
橄榄后沟区被认为是较顺利的延髓入路,枕下低中线颅骨切除术和颈椎椎板切开术(图4G,4H,4I)是目前用于髓和颈髓交界部胶质瘤的入路。当这些肿瘤位于内侧时,较好通过中线纵向脊髓切开术。位于更侧面或腹侧的肿瘤较好采用Spetzler和Grahm描述的背外侧入路。对于位于延髓腹侧中部的肿瘤,此通路可充分暴露延髓前外侧、颈髓交界处、Luschka孔、CN-IX至CN-XII及相关动脉。扩大到下脑干的轴内病变可通过限制性乙状窦后开颅和C1半椎板切除术,必要时钻入枕髁后三分之一处,不超过髁后三分之一以保持稳定性。此外,在切除颈髓胶质瘤时,小脑后下动脉可能会受到损伤。因此,在切除前需对其进行鉴别。
外生肿瘤
背侧外生肿瘤主要局限于四脑室底。标准方法之一是中线枕下开颅术(图4A)。大部分的揭穿发生在脑干之外。在肿瘤揭穿前,应暴露四脑室底。在肿瘤切除过程中,可以绘制四脑室。如果肿瘤导致四脑室底变形,超声可以用来确定肿瘤较靠近基底的位置。cn6和cn7的细胞核和/或轨迹易受损伤;这是术中神经生理学发挥重要作用的地方。这些外生肿瘤在蚓部裂开后暴露出来。过度牵引可出现小脑缄默症和假性延髓症状。此外,在切除颈髓胶质瘤时,小脑后下动脉可能会受到损伤。小脑后下动脉横向移位。其目的是刮除肿瘤,使其与周围脑室底齐平,除非肿瘤与正常脑组织有明显区别,而且神经生理学监测显示没有变化,否则不要在这个平面上从腹侧继续。一个需记住保持良好的可视化室管膜上下肿瘤,以及避免切除低于室管膜底。然而,由于这些病变多发生在四脑室底,肿瘤的完全切除可能是不可能的。因此,大部分背侧外生肿瘤可以成功地通过次全切除和脑脊液转移治疗。
如果病变位于面丘并指向四脑室底,则可通过枕下开颅-蚓部-保留末梢入路,经面下三角区入路。这种方法可以通过使用神经导航和显微镜进一步评估。
术后护理和可能的并发症
患者的症状和体征通常会被监测。在处理累及延髓的病变时,较常见的术后风险之一是进行性二氧化碳潴留。术后48小时内可出现呼吸衰竭,并伴有部分延髓损伤。因此,患者应在重症监护室密切监护,甚至在术后至少48至72小时插管。在连续24小时稳定的呼吸驱动后,患者将脱离呼吸机。通过机械通气和必要的镇静剂维持口腔或鼻气管插管。进行CT扫描以排除早期出血、脑积水和气脑。如果CT扫描正常,当患者达到正常通气,咳嗽和吞咽正常时,气管导管可顺利取出。术后的前3天,患者接受高剂量类固醇(例如根据体重,每6小时服用6毫克地塞米松),随后根据临床需要逐渐减少剂量。
一般情况下,如果使用非吸收性皮肤缝线,只要没有脑脊液渗漏的迹象,就可以在手术后10天内取下缝合线。颅神经损伤与肿瘤部位、手术入路及脑干损伤有关。下颅神经损伤在延髓脑干手术中相当常见,约三分之二的患者恢复或明显好转。大多数患者在术后的几周内会出现吞咽功能的暂时恶化和困难,有些患者没有好转。报告术后数周至数月内突然死亡。有些病人由于吞咽困难和气道保护而长期需要气管造口和胃造口管,手术前需与病人及其监护人讨论这一问题以及其他可能出现的并发症。
其他常见的并发症包括与小脑,是蚓部手术和牵引有关的并发症,如缄默症和行为改变,约有10%的患者出现这种情况。脑干局灶性病变和术前接受放疗的患者在围手术期和术后发病的风险更高。
预后与术后预期
到目前为止,脑干胶质瘤较重要的预后指标是病灶的位置以及是否压迫或浸润周围结构。在一项涉及48名成人的研究中,持续超过3个月的症状被认为是一个有利的预后因素。根据Teo和Siu,一般有三分之二的患者术后状态与术前相比有所好转,58%的低级别和高级别胶质瘤患者在术后持续恶化。他们还记录了全部患有低级别胶质瘤的患者存活5年,而高级别胶质瘤的患者只有三分之一存活。脑桥肿瘤患者比中脑和颈髓肿瘤患者发生手术并发症的风险更高。
弥漫性浸润性脑干胶质瘤的患者一般不接受手术治疗,预后较差,2年的总生存率为5-20%。年龄较大、无CN缺陷和长径路症状、体征和症状持续时间较长的患者预后较好。弥漫性脑干胶质瘤患者肿瘤内出血可能使临床处理复杂化。有利的预后因素包括:病灶的震中位于脑干的非脑桥区,病史较长,神经系统局灶性阳性,影像学检查肿瘤内信号一致,或CT上呈flair高信号和钙化。同样,生长模式局限于一个节段,或当四脑室底有偏差时,囊肿的存在和神经纤维瘤病都被认为是良好的预后因素。但是肿瘤坏死和脑积水的影像学表现无预后意义。严重的术后并发症和神经功能缺损是下颅神经可能会对预后产生负面影响。
总之,随着显微外科技术、复杂的术前和术中影像学和神经生理学技术的逐步进步,局灶性脑干胶质瘤的治疗取得了进展,但它仍然被认为是较难治疗的肿瘤之一。
资料来源:doi: 10.17712/nsj.2015.2.20140621




