脑膜瘤是较常见的颅内肿瘤。包括WHO I级(81.1%)、“非典型”WHO II级(16.9%)和间变性(1.7%)或WHO III级肿瘤。虽然I级和II级肿瘤以女性为主,但间变性(恶性)脑膜瘤没有。脑膜瘤患者的10年总生存率(OS)随年龄而变化,范围在57%到77%之间。然而,二级和三级肿瘤患者的5年复发率分别为50%和90%。尽管目前已有进展,这些患者的10年生存率分别为53%和0%。
非典型脑膜瘤患者的治疗选择包括观察、切除和放疗(RT),包括立体定向放射外科(SRS)、分次放疗(FRT)或上述方法的组合。治疗方案的考虑包括局部肿块效应、神经症状和膀胱周围水肿。在全切除术(GTR)之后,建议观察或辅助放疗。次全切除或部分切除,治疗标准是辅助放疗,这已经被证明可以好转局部控制和总体生存率。目前的国家综合癌症网络指南建议54-60gy的剂量范围为1-2cm。然而,有多个回顾性研究已经着眼于使用SRS而不是FRT,并且证明了良好的局部控制和良好的毒性。
放疗的副作用包括症状性水肿,可导致头痛、头晕、癫痫发作和认知能力下降,以及长期存在神经认知缺陷、颅神经缺损和继发性恶性肿瘤的风险。FRT的主要并发症并不常见。在这篇文章中,着重介绍了两个非典型脑膜瘤患者,他们在疾病控制的情况下,临床结果不佳。
案例1:
临床表现与手术
一位61岁的右撇子男性,有糖尿病病史,表现为1周头痛和神志不清。神经系统检查对地点和时间方向感障碍呈阳性,其余的检查并不。MRI显示左侧额叶3.5×4.8×3.6厘米病变,邻近硬脑膜强化,左侧额角出现肿块效应(图1)。病人开始服用类固醇,临床症状开始有所好转。手术时,我们的评估是通过左额叶开颅术对其病变进行GTR(Simpson一级)。
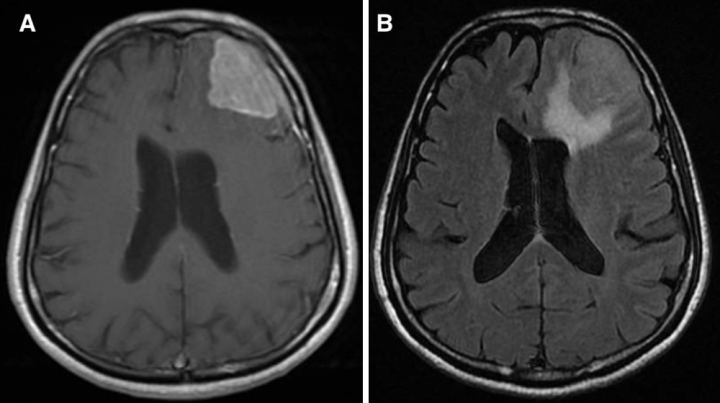
图1:患者1,术前造影增强t1加权(A)和t2加权FLAIR (B)显示左侧额叶病变伴邻近硬脑膜强化,导致左侧额角肿块效应及周围血管源性水肿。
病理结果
组织病理学检查显示非典型脑膜瘤,WHO II级,具有中度到局部高细胞密度。免疫组化显示10%的细胞具有孕酮免疫反应性,Ki-67指数为25%(图2)。在3%的肿瘤细胞中发现p53免疫反应。有丝分裂指数高达10次/10hpf。
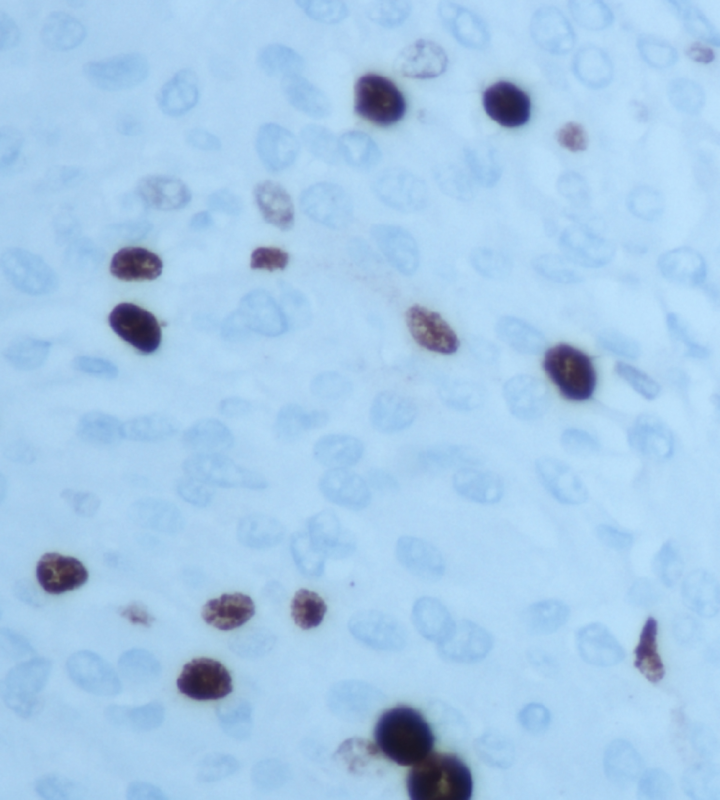
图2:免疫组化染色Ki-67标记指数25%,放大倍数40。
术后情况
病人对手术的耐受性很好,没有并发症。术后5天出院回家。术后1个月之MR影像显示左额叶手术缘有结节样强化,并伴有持续性血管源性水肿及右侧镰下疝。症状方面,病人有持续的记忆和语言障碍。手术9周后,他开始了FRT疗程,总治疗剂量为60 Gy (2 Gy×30分,图3)。由于空洞的大小、对术后影像学残留疾病的担心和病理发现,后续提供了分级治疗。
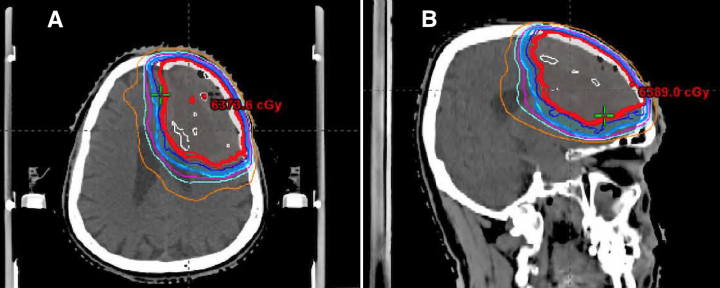
图3:患者RT治疗方案累积剂量-体积直方图、轴向放射治疗计划(A)和矢状放射治疗计划(B)。60 Gy的处方剂量包括切除腔附近的大量左侧额叶,并包括图示的放射性坏死区域。
在接受放射治疗的三周后,病人需要进行颅骨切除术和左额硬膜外脓肿清除术,同时进行钛网颅骨成形术。切口愈合后,按计划剂量60gy进行RT,中断2周。
四个月后的监视影像显示脓肿消退,水肿减轻。左侧额角仍有T2/FLAIR信号异常,空泡外轻度扩张。病人能够回到仓库主管的岗位上工作,尽管他的工作效率受到情绪不稳定和控制解除的限制。
在接下来的18个月里,监视成像显示沿额角的强化区域进一步增大,左侧侧脑室额角的空泡扩大水平增大(图4A和B),但没有肿瘤复发的迹象。病人诉说他渐进性疲劳,难以集中精神,而且他不能再履行他的工作职责。经过检查,他说话少了,也不了解自己的情况。他开始服用低剂量的类固醇,但症状没有明显好转。
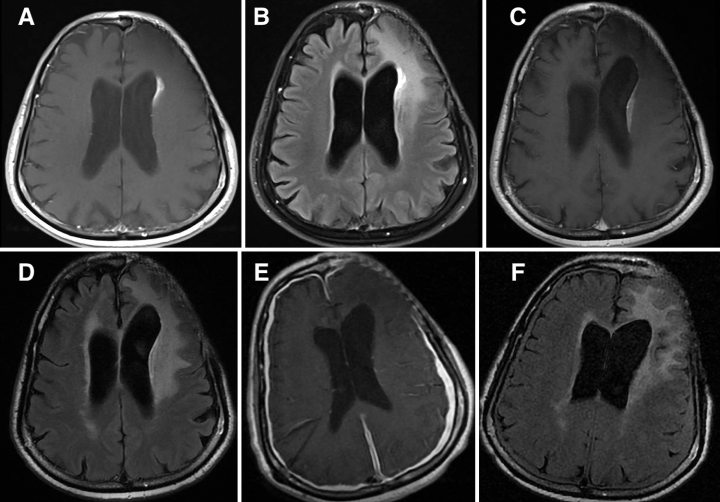
图4:病人1,对比增强T1加权(A)和T2加权FLAIR(B)术后20个月的磁共振图像显示沿前角增强的大小增加。术后24个月T1加权对比增强(C)和T2加权FLAIR(D)磁共振图像显示左额脑室周围增强,左侧脑室真空外扩张,脑室整体增大,这与脑积水有关。术后52个月T1加权对比增强(E)和T2加权FLAIR(F)显示脑室周围强化分辨率的磁共振图像(注意脑室-腹腔分流的硬脑膜强化和少量硬膜下积液)。
术后24个月,他的家人注意到病人变得更加古怪和好斗。他也更容易冲动和迷失方向,走路困难,经常摔倒。他不能再听从命令,大小便失禁。核磁共振显示左额脑室周围增强,左侧脑室真空扩张,脑室整体增大,与脑积水有关(图4C和D)。
患者接受了脑室腹腔分流术,较初神经系统有所好转,但在接下来的几周内恶化,因为他的术后病程因分流术过度引流(通过钻孔引流和将分流阀调节到更高的打开压力进行治疗)而导致右侧小硬膜下血肿。手术后52个月的较后一次随访时,他的磁共振成像显示室周增强的分辨率和略微好转的T2信号延长(图4E和F)。他仍然患有严重的表达性和接受性失语症,完全依赖辅助日常生活活动(ADL)。
案例2:
临床表现和手术
一名73岁的右利手妇女出现头痛、头晕、左侧听力损失、左侧面部麻木、思维混乱和行走困难2个月。检查显示左下肢轻度无力(4/5级),左鼻子麻木,左侧完全失聪,并有龙贝格征。核磁共振显示左侧桥小脑角肿瘤4.9 × 4.2 × 3.1厘米,对脑干和四脑室有肿块影响(图5A),符合脑膜瘤。她接受了左侧乙状窦后开颅术进行诊断,并计划对她的肿瘤进行次全切除术。术后SRS是初始管理策略的一部分。
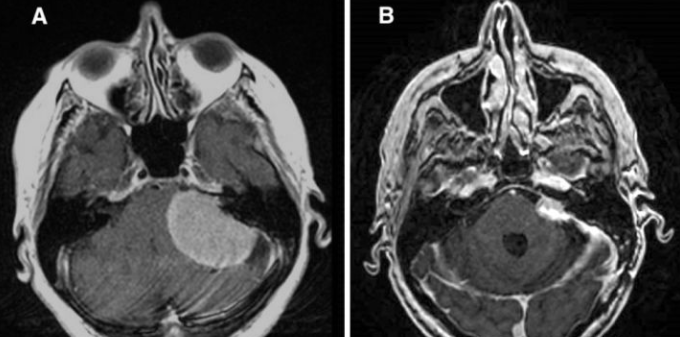
图5:病人2,A:术前增强t1加权像显示左侧桥小脑角肿瘤,肿块位于脑干和四脑室。B:术后2个月,放疗前增强T1加权像显示残留肿瘤。
病理结果
切除病灶的组织病理学检查显示脑膜瘤有坏死、钙化、大核仁和高核分裂指数(4-5个核分裂/10个hpf)。这些特征将肿瘤归类为非典型,WHO二级脑膜瘤。免疫染色显示Ki-67标记指数高达10%-15%。
术后情况
病人对手术的耐受性很好,没有并发症。她在术后6天出院回家。术后核磁共振显示肿瘤残留(图5B)。患者在术后6个月的间隔期内按计划恢复,此时的MRI显示肿瘤体积比放疗前缩小(图7A)。
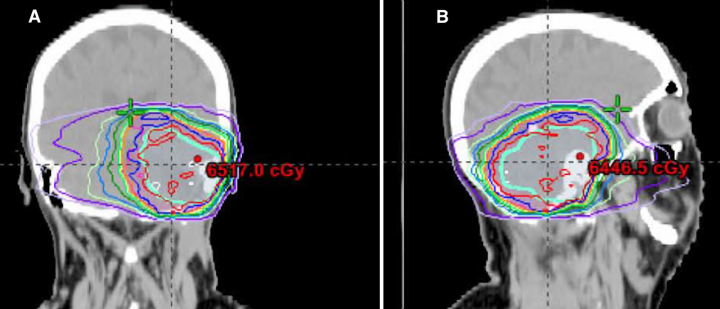
图6:患者2的放疗计划。累积剂量-体积直方图,冠状动脉放疗计划(A)和矢状放疗计划(B)。与患者1一样,60Gy的处方剂量覆盖了大部分大脑,包括左颞叶的重要部分。对残留肿瘤的选择性放射治疗计划可以避免照射这么大的体积。
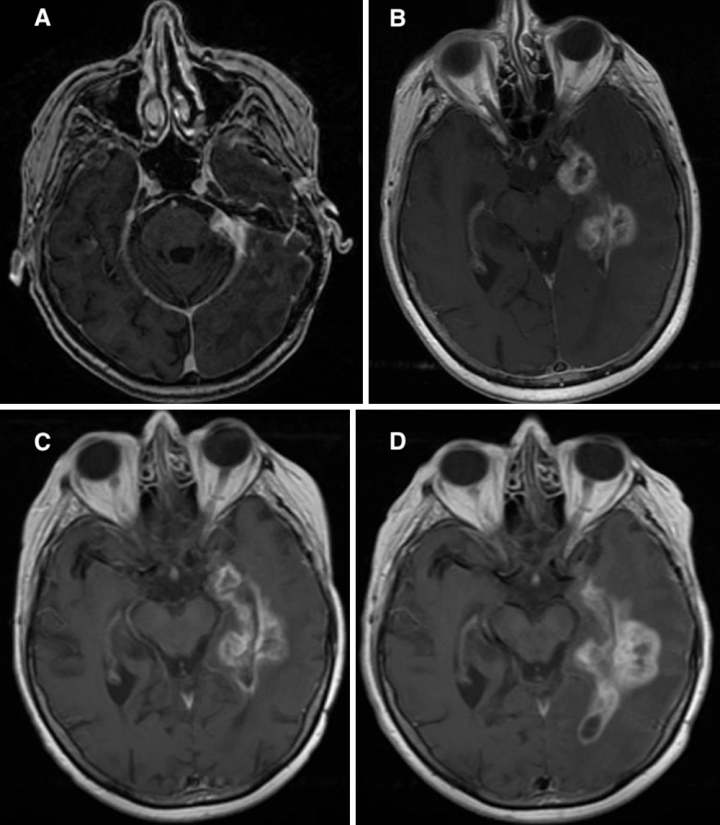
图7:病人2,A:术后6个月及术后rt后,t1加权序列造影显示肿瘤体rt前减小。B:术后21个月t1加权序列造影显示左侧颞叶增强病变,行活检。C:活检后5个月,t1加权造影显示病灶稳定增强,整体占位性降低。D:一开始活检11个月后(二次活检时间)t1加权MR增强图像,增强病灶间隔增大,延伸至左侧顶叶。
案例讨论
尽管进行了全部或接近全部手术切除,非典型脑膜瘤患者仍有的复发率。辛普森ⅰ级和ⅰ/ⅱ级切除的5年复发率分别高达50%和71%。较初的治疗选择包括观察、有或没有辅助放疗、放疗或大分割放疗的切除术,以及对不良手术候选人和不能手术的肿瘤的单独放疗。目前的指南建议对患有世卫组织GTRⅱ级肿瘤的患者进行观察或辅助放疗。对于有短串联重复序列的患者,建议使用辅助性逆转录病毒疗法。非典型脑膜瘤患者的辅助放疗与中位5年无进展生存率54.2%(范围38%-全切)和操作系统67.5%(范围51%-全切)相关。有丝分裂数和Ki-67增殖指数已被评估为评估非典型脑膜瘤复发的预后因素。有丝分裂指数为3C 4,Ki-67 %3E 10%患者3年局部复发率为34%,Ki-67 ≤ 10%患者3年局部复发率为17.1%。对于有丝分裂数较高(≥ 4)的患者,3年局部复发率分别为48.6%和31.1%,Ki-67>10%和≤ 10%。
在本报告中,两位患者在接受FRT辅助治疗后,尽管没有复发的迹象,但临床结果很差。两例患者均接受术后FRT(图3和图6)。
治疗的毒性
非典型脑膜瘤患者RT毒性率在3.4%至16.7%之间。具体来说,RT治疗导致的脑坏死率是可变的,从高达23.1% 33%(尽管这是III级肿瘤)、12.5%、2和4.2%到低至0.1%。根据不良事件常见术语标准v3.0,有29例4级晚期毒副作用被报道为脑坏死和认知障碍。4级和3级毒副反应发生率分别为2/119(1.7%)和6/119(5.0%)。其他毒性率包括脱发(8.3%)和癫痫发作(4.2%)。RT术后的中风风险比SRS高12倍。
放射性坏死是SRS和FRT的重要并发症,应及早发现并妥善处理。MRI上的辐射改变包括t1加权像信号低化和t2加权像信号高化。典型的CT表现为放射性坏死,表现为治疗视野内的低密度变化。放射性坏死不仅仅是一种影像学诊断。相反,术后窗口期症状的出现和肿瘤复发的消失与症状的出现和影像学上的相关性一起分类为放射性坏死。
虽然放疗很少出现急性并发症,但累积剂量的辐射可导致明显的神经认知改变或放射性坏死。低分割SRS技术被描述为对较大肿瘤体积的毒性较小。Bria等人。据报道,在没有任何短期毒性的II级脑膜瘤患者中,低分割SRS导致了71%的局部控制率。在辅助治疗的情况下,SRS、低分割SRS和RT的直接比较仍然缺乏高水平的证据。36侵袭性更强的肿瘤面临挑战,因为SRS具有更严格的保形计划,与RT相比,在肿瘤控制方面可能不足。相比之下,SRS的并发症率在2.5%到37%之间,而RT的变化范围为2%~42%。影响因素包括肿瘤体积、肿瘤组织学、预处理水肿和累积辐射剂量。大多数SRS术后并发症包括膀胱周围水肿,SRS的分离可减少并发症费率。佐剂SRS在手术腔内有肿瘤复发的风险,但可用于局部肿瘤复发,从而避免了大剂量照射引起的放射性坏死风险。
毒性管理
皮质类固醇治疗是治疗相关水肿或放射性坏死患者的选择治疗。我们的两名患者在接受放射治疗12个月后都有明显的认知能力下降,没有肿瘤复发或进展的证据。起初类固醇治疗对每个病例都有帮助,但两例患者的神经功能均持续下降,并维持长期性的功能缺损,没有任何肿瘤进展的迹象。贝伐珠单抗已被描述为激素耐药放射性坏死患者的一种治疗选择。然而,考虑到我们的病人并没有明显的肿块效应,并且在神经上受到损害,我们认为这种治疗没有作用。
结论
虽然SRS和FRT作为一种微创和高效的技术已经改变了脑瘤的治疗,但它们存在固有的局限性和并发症,手术仍是一线治疗方案。文中描述了两位在标准FRT后发生严重并发症的患者。用小体积SRS在一个或多个部分治疗,可能降低这些改变生活的事件的风险,但这种方法可能增加切除腔内肿瘤复发的风险。FRT的治疗效果可以通过降低传统使用的CTV和PTV边际值而得到进一步好转。为了更好地控制肿瘤,降低复杂肿瘤患者的并发症发生率,需要进行比较研究和个体化治疗。
质子治疗作为当前新兴放疗手段的一种,其对部分脑肿瘤具有的治疗优势。由于质子治疗准确,因此用质子治疗进行脑瘤治疗可以针对目标肿瘤进行高效且可能更高剂量的射线照射,而对周围组织的损伤则更少,从而降低了因放疗而出现新的神经功能缺损,激素缺乏或智力障碍的风险,较大限度地控制肿瘤,同时较大水平地减少附带损害,提高治疗效果。
相关参考资料:DOI: 10.3171/2019.3.FOCUS1930.




