现在已经确定星形胶质细胞在支持正常大脑功能中起重要作用。这在很大水平上是由星形胶质细胞突起完成的,这些突起形成覆盖脑血管表面约99%的末端。星形胶质细胞末端,与周细胞结合,有助于维持内皮紧密连接蛋白、转运蛋白和酶的表达,它们共同构成血脑屏障。此外,星形胶质细胞可以将一些血管活性分子从它们的末端释放到下面的血管平滑肌细胞上,调节血管张力。这个过程被称为功能性充血或神经血管耦合(NVC),调节局部脑血流以匹配区域神经元能量需求。NVC是通过将神经元活动转化为星形胶质细胞的增加来实现的,其导致几种血管活性分子的产生和/或释放,包括花生四烯酸代谢物环氧二十碳三烯酸、腺素E2(PGE2)和20-HETE或K+。这些代谢物作用于大脑小动脉内壁的平滑肌细胞,导致它们扩张或收缩。
原发性神经胶质源性脑瘤是高度侵袭性的癌症,通常沿着现有的脑结构(包括脑白质轨迹和血管)迁移。内皮衍生的缓激肽较初将胶质瘤细胞吸引到脉管系统这些血管周围的细胞外基质富含促进细胞迁移的分子,如纤连蛋白和玻连蛋白。神经胶质瘤细胞与脉管系统的相互作用以三种不同的方式发生:(1)沿已存在的脉管系统迁移的神经胶质瘤细胞的血管周围侵袭和(2)已存在的宿主脉管的共同选择在肿瘤生长初期或由小卫星肿瘤引起。随着疾病的进展和肿瘤块的生长,增广的血管较终经历凋亡和(3)通过释放血管生成分子如血管内皮生长因子来诱导血管生成在肿瘤的边缘。在这项研究中,我们专门关注了迁移的胶质瘤细胞与主要肿瘤块外现有脉管系统的相互作用。
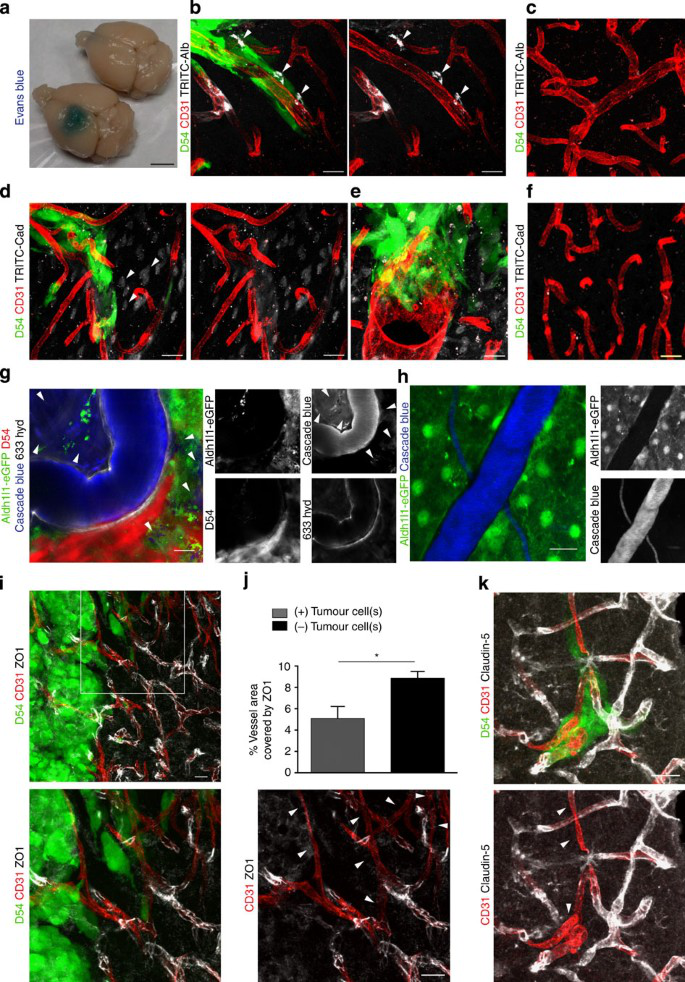
考虑到星形胶质细胞末端广泛覆盖脑血管,我们询问了沿血管侵入或共同选择血管的胶质瘤是否会改变原有脉管系统中星形胶质细胞-血管的相互作用。使用几个临床相关的神经胶质瘤小鼠模型,我们表明多数人神经胶质瘤细胞在与血管相关的主要物质之外移动,并插入到已存在的血管的末端和内皮壁之间,证实了以前使用啮齿类神经胶质瘤细胞系的报道。末端和血管之间失去接触会导致紧密连接(TJs)的丧失,从而导致血脑屏障的局灶性损害,使血液携带的分子即使远离主要肿瘤块也能进入脑实质。此外,星形胶质细胞从血管中的物理脱位以及随后由胶质瘤包裹的血管损害了星形胶质细胞-血管的耦合。重要的是,单个胶质瘤细胞足以局部打开血脑屏障并局部损害胶质血管的偶联。这些发现对肿瘤相关脑中的血流和疾病中局部递送化疗药物的能力具有重要的临床意义。
神经胶质瘤细胞的血管共选择突破了血脑屏障
血脑屏障的发育先于星形胶质细胞的发育,并由周细胞诱导30,31然而,完整屏障的维持依赖于星形胶质细胞释放的可溶性因子以及星形胶质细胞和内皮细胞之间的持续接触。因此,损害星形胶质细胞的病理状态也存在于受损的血脑屏障中。漏血脑屏障也是新生成的缺乏TJs的神经胶质瘤血管系统的典型特征。这可以很容易地通过埃文蓝从血流渗透到大肿瘤块周围的脑实质中来证明。
血管周围神经胶质瘤细胞共选择导致血脑屏障的损害。
在肿瘤侵袭区域,血流的变化不再受星形胶质细胞的调节,这与神经胶质瘤患者的血流减少相一致。此外,当失去联系时,星形胶质细胞不能再运输能量代谢物,如乳酸盐,来为神经元提供能量。缺乏足够的能量供应可能会加速兴奋毒性神经元的死亡。有趣的是,许多其他神经疾病,如阿尔茨海默氏病,高血压和糖尿病也有报道称NVC受损,这可能导致这些疾病中的每一种出现复杂的病理过程。
较后,我们发现血管相关胶质瘤细胞可以调节血管张力。我们的数据表明,由于Ca2+激活的K+通道介导的K+释放,这是我们通过激活PAR1受体,在胶质瘤中高度表达的实验诱导的血管收缩。鉴于Par1在其他中枢神经系统细胞中的表达已有报道,我们通过胶质瘤细胞中Ca2+的细胞类型特异性光解衰老来补充这一方法,并证实了胶质瘤细胞中人工Ca2+增加后的血管反应。我们没有看到任何反应时,控制血管刺激,这表明,在我们的实验条件下,TFLLR诱导的PAR1激活不诱导血管活性分子从星形胶质细胞或内皮释放。值得注意的是,PAR1受体活化可能在人类疾病中发生。天然PAR1配体是血液传播的凝血酶或纤溶酶,它可以通过在脑胶质瘤存在的区域中的病灶破裂的BBB进入大脑。
钾对血管的调节K+通过Ca2+激活的K+通道首先出现在皮质星形胶质细胞中,依赖于K+血管扩张或血管收缩。胶质瘤细胞高表达Ca2+激活的K+通道,包括BK和IK通道。早期实验表明,这些通道促进了入侵和迁移但是我们的研究现在提出了一种机制,通过这种机制,神经胶质瘤细胞利用这些通道来传递K+以调节血管直径。
胶质瘤介导的对血管直径的控制可能是支持胶质瘤生物学不同方面的特定环境。更具体地说,侵入的神经胶质瘤细胞可能会诱导血管收缩,试图增加血管周围的空间,以促进血管周围的侵袭。另一方面,生长的卫星肿瘤可能受益于扩张的血管向肿瘤分流额外的血液。在这两种情况下,损害这种肿瘤对血流的控制可能会损害肿瘤的生长或侵袭,应在未来进行治疗。




