放射治疗是头颈部原发及转移肿瘤的重要治疗方法。放射性脑损伤是头颈部肿瘤患者在放射治疗后产生中枢神经系统损害症状的疾病,是肿瘤患者放疗后的严重并发症,偶发于电离辐射事故中。近年来,放射性脑损伤的确诊率总体呈上升趋势。
放射治疗是脑转移瘤治疗的基础。历史上,全脑放疗(WBRT)曾是可用的治疗方式。单独使用全脑放疗进行治疗虽然可以缓解症状,但患者的生存率仍然很差。技术的进步已使得放射外科(SRS)得到广泛地应用,并且放射外科在控制脑转移瘤方面的合适性也得到了很好的证明。
通常会联合使用上述的两种方法,要么先期使用,要么作为抢救性(salvage)治疗。之前随机对照试验表明,在全脑放疗基础上补充放射外科治疗,能好转局部颅内病灶的控制和单个脑转移瘤患者的生存。相比之下,使用放射外科治疗,(而不行全脑放疗),患者有更高的出现远隔处颅内转移瘤复发的风险,但不会损害生存。因此,国家综合癌症网络指南(National Comprehensive Cancer Network guidelines)建议患者特别是若接受单独使用放射外科治疗后,每隔2-3月进行常规磁共振成像监测。通常,在随访期的扫描中检测到的与治疗相关的变化与肿瘤复发难以区别。这给许多临床医生造成了诊断中的窘境,因为每个临床医生的处理都会有很大的不同。脑转移瘤治疗的并发症之一是症状性放射性坏死;这通常会影响患者的生活质量,并可能导致严重的并发症发生率。
《Frontier in Oncology》杂志2018年9月28日在线发表新加坡国立大学癌症研究所的Vellayappan B,Tan CL,Yong C等撰写的《脑转移瘤患者放射性脑坏死的诊治Diagnosis and Management of Radiation Necrosis in Patients With Brain Metastases》(doi:10.3389/fonc.2018.00395.)
放射治疗不管采用的是立体定向放射外科治疗(SRS)或是全脑放疗(WBRT)哪种形式,仍是治疗脑转移瘤(BM)的基石。由于改进了全身系统性治疗,(从而能更好地控制颅外病变),和增加了放射外科的应用,(从而能提高颅内病变控制),脑转移瘤患者的生存延长,患者临床上会显现出放射治疗的迟发效应。迟发效应之一是放射性脑坏死(RN)。不幸的是,众所周知,伴有症状的放射性脑坏死难以诊断和治疗。放射性脑坏死(RN)的特点与肿瘤复发有很大的重叠,将放射性脑坏死误诊为肿瘤复发可能会带来对患者有害的治疗,对患者造成不利影响。在这篇综述中,作者将探讨放射性脑坏死的病理生理学,进展的危险因素,以及评价和处理放射性脑坏死的策略。
放射性脑坏死的发病率
对于脑转移瘤,放射性脑坏死的真实发生率难以估计,可能在5-25%之间。放射性脑坏死的定义因研究而异,只有一些需要组织学证实。此外,广泛的差异可能是由于提高了诊断成像的质量和检查频率,强化了肿瘤学界的意识(从而更好地予以报告)和随访期的延长。例如,Chin等的研究,病理证实或时间分辨率(temporal resolution)是必需的,据报道放射性脑坏死的发生率为7%。相比之下,主要使用影像进行诊断,Minniti等报道的放射性脑坏死的发生率为24%(14%为有症状的,10%为无症状的),诊断依据成像特点,如对比增强增加,病灶无进展超过4个月,动态MRI序列灌注减低(reduced perfusion on dynamic MRI sequences)。
放射性脑坏死的病理生理学
早期的实验是对大鼠和狗进行单次脑部照射(10-25Gy)。这些实验显示,脑部的辐射耐受性与治疗剂量、治疗容积存在复杂的关系,并且与辐射后时间的持续有函数关系(function of time elapsed)。这些动物实验的组织病理学分析表明,在受辐射的区域,存在血管和脱髓鞘改变。持续高剂量会导致脱髓鞘和坏死,以及出现早期坏死的表现。
放射性脑坏死的病理生理学里面存在两种理论,然而的原因很可能是多因素所致。
1.血管损伤理论
辐射损害血脑屏障,导致毛细血管渗漏性和血管通透性增加。辐射,特别是在分割剂量>8Gy时,会激活酸性鞘磷脂酶(acid sphingomyelinase),引起神经酰胺增加(upregulation of ceramide),进而导致内皮细胞凋亡(endothelial apoptosis)。这也导致氧自由基(oxygen-free radicals)增加,(通过释放肿瘤坏死因子和白细胞介素-1 beta)形成促炎环细胞因子环境,血管内皮生长因子(VEGF)和细胞间粘附分子(ICAM-1)增加。这个串联起来的变化引起小血管狭窄和纤维样坏死,造成缺血和细胞死亡。
胶质细胞理论
辐射也会损伤胶质细胞。少突胶质细胞损伤及其祖细胞(progenitors)的损伤会导致出现脱髓鞘(demyelination)。缺氧引起的内皮细胞损伤会导致低氧诱导因子1α(hypoxia-inducible factor 1α)和血管内皮生长因子VEGF的释放。VEGF诱导形成新生血管(neo-angiogenesis),但这些往往是渗漏的毛细血管;会造成病变周围水肿和对比增强剂外溢(extravasation)。
放射性脑坏死和风险因素的缓解策略
放射性坏死的直接的因果关系尚难确立,但许多危险因素已经被确定。这些因素包括肿瘤体积、处方剂量、分割次数、正常脑组织受照容积、既往接受过的放射治疗,以及同步进行的全身系统性治疗。这些危险因素中有许多是在治疗动静脉畸形和胶质瘤的患者中确定的,但可以外推断为到脑转移瘤的治疗中。
1.剂量-体积(Dose-volume)的相互作用
a.RTOG 90-05的早期研究中建议根据肿瘤体积确定较大顺利照射剂量。在12个月的放射性坏死的累积发病率为8%,较大的肿瘤会增加放射性坏死的发病率。例如,病变≤20毫米,可以用24 Gy顺利治疗;病变大小在21-30毫米,则使用18 Gy;病变大小在31-40毫米,使用15 Gy。然而,这些数据是基于复发的原发性和继发性脑肿瘤的混合进行的,而且全部的患者都曾接受过放射治疗。
b.对于接受放射外科治疗(联合或不联合全脑放疗)的患者,受照大于10或12Gy(分别为V10和V12)的脑实质容积与放射性脑坏死相关。Blonigen等报道,当V10>10.5 cm3或V12>7.9 cm3时放射性坏死的风险更高。V10和V12的使用相互验证了AVM和其他颅内肿瘤的研究。目前尚不清楚如何定义这个具体体积,特别是是否要将肿瘤的总体体积排除在正常脑实质之外。为了减轻这种风险,已经提出进行分割立体定向放射治疗,但仍然缺乏强有力的对比性研究证据。
既往的辐射暴露
既往使用全脑放疗WBRT或放射外科SRS治疗与再照射之间的间隔时间影响放射性脑坏死的风险。例如,在有既往(同一病变)接受放射外科治疗史的患者,再次放射外科治疗后出现放射性坏死的的风险报告在治疗后1年时发生率为20%,在既往接受过全脑放疗WBRT的患者,放射性脑坏死的发生率为4%,而同步使用全脑放疗WBRT时则为8%。没有接受过放射治疗的患者,报告的放射性脑坏死的发生率风险为3%。有既往全脑放疗WBRT史的患者,尚不清楚全脑放疗的分割次数规模是否会影响风险。
3.化疗
对原发性脑肿瘤应用化疗惠增加放射性脑坏死的风险。在脑转移瘤中,在放射外科治疗1个月内使用卡培他滨(capecitabine)似乎会增加放射性脑坏死的风险。
4.位置
A.根据AVM的研究推论,脑部的某些部位可能有更高的出现放射性脑坏死的风险。额叶皮层出现放射性脑坏死的的风险似乎较高,而脑干对进展出现放射性坏死更有耐受性。
b.日本的研究人员认为,由于剂量溢出到脑实质外的组织(颅盖骨、皮肤等),浅表的病变出现放射性脑坏死的风险较低。
5.组织学
a.Miller等认为某些组织学亚型出现放射性坏死的风险更高。这些肿瘤包括肾癌、肺腺癌(特异性ALK重排ALK rearrangement specifically)、HER-2扩增型(amplied乳腺癌和BRAF V600野生型黑色素瘤。
6.计划目靶区容积(PTV)边缘外扩
a.对较大的大体肿瘤体积(GTV)进行计划目靶区容积(PTV)边缘外扩会带来设置和位置的不确定性,但造成的结果是靶区体积增加,处方等剂量线包含较大的正常脑实质容积。在一项随机试验中,比较1 mm和3 mm的GTV-PTV边缘外扩,两组的局部控制率相似,但3 mm组有更高的活检验证的放射性脑坏死的发生率(12.5对比2.5%,p=0.1)。虽然临床上具有性,但由于患者人数较少,可能难以达到统计学意义。
7.固有的辐射敏感性(Intrinsic radiosensitivity)
来自AVM治疗的数据表明,进展出现放射性坏死的患者对辐射的敏感性增加。这是通过(体外实验)来自于出现放射性脑坏死的患者的皮肤成纤维细胞的生存曲线证实。虽然固有的福射敏感性可能是一个危险因素,但在临床中没有实际的方法来量化这一点。
疑似放射性脑坏死的诊断和研究
•影像
磁共振成像是研究放射性脑坏死的较常用的方法。然而,放射性脑坏死和肿瘤复发的影像学特征有相当程度的重叠,这两者均表现出程度的对比增强后强化和病变周围脑水肿。大多数情况下,这两者会同时存在。
这两者并无特定的单纯暂时性的改变(即,随着时间的推移会增大)。虽然文献中所描述的某些增强模式如“瑞士奶酪(Swiss cheese)”、“肥皂泡()soap bubble)”或“切青椒(cut green pepper)”较初被认为有利于放射性坏死的诊断,但它们只有25%的阳性评估值。Dequesada等指出,陀螺状的(gyriform)病变和脑水肿,伴有边缘或实体强化提示至少有一些有活力的肿瘤,补充损伤系数(LQ)(T2序列上结节与在T1序列上的增强总面积的比值)>0.6,提示肿瘤复发,而<0.3的LQ更符合放射性脑坏死。然而,其他作者发现这个特性只有8%的敏感性。
在实践中,传统磁共振的特征低评估价值促使人们需要更前沿的工具,如磁共振波谱(MRS)、磁共振灌注和正电子发射断层扫描(PET),以帮助提高诊断信心。下面将讨论这三种高级技术。
磁共振(MR)灌注
存活的(Viable)肿瘤具有完整的血供(intact vasculature),因此比坏死组织有更高的灌注和血容量。基于动态磁敏感加权MRI的相对脑血容量(rCBV)增加被用于鉴别肿瘤和坏死。遗憾的是,发表的数据并不一致。Hu等报道相对脑血容量(rCBV)<0.71对于放射性坏死有92%的敏感性和全切的特异性,而另一项研究表明相对脑血容量(rCBV)的截值<2.1(全切的敏感性和特异性)。Barajas等报告相对脑血容量(rCBV)值的重叠,并提出使用信号强度恢复百分比(PSR)。此外,不同机器间的相对脑血容量(rCBV)值不同,依赖于采集方法,并且受到信号强度堆积伪影(signal-intensity pileup artifacts)、血液和病灶内对比剂淤积形成的磁敏感性伪影(susceptibility artifacts from blood and contrast pooling within the lesions)的干扰。体素内非相干性运动(IVIM)是另一种基于扩散加权成像(DWI)MR采集提供定量扩散和灌注测量的方法。体素内非相干性运动(IVIM)在鉴别复发性肿瘤与放射性脑坏死方面优于相对脑血容量(rCBV),并已经作为黄金标准的组织病理学所验证。
磁共振波谱(MRS)
评估脑转移瘤中的代谢物的成分是另一种有用的方法,相关阈值已经发表。胆碱-肌酐(Cho:Cr)比值和胆碱-N-乙酰天门冬氨酸(Cho:NAA)比值增加可能提示肿瘤复发。Zeng等发现当Cho:Cr比值和Cho:NAA比值均>1.71时,敏感性、特异性和诊断准确率分别为94.1%、全切和96.2%。相反,脂质-乳酸峰值的升高和其他代谢物的普遍减少支持放射性脑坏死。MRS受到体素大小的限制,通常要求病灶体积大于1 cm3,而且还受异质性肿瘤内采样误差的影响。化学交换饱和转移(CEST)是一种对移动蛋白和多肽类敏感的新方法,在放射外科治疗后的肿瘤复发鉴别中具有早期应用的前景。
PET-CT
PET成像具有比磁共振波谱(MRS)更好的空间分辨率和覆盖范围,依赖于假定肿瘤中的葡萄糖代谢增加在1982年一次提出在这个临床环境中使用氟脱氧葡萄糖(FDG)PET。然而,多项研究表明氟脱氧葡萄糖FDG-PET对诊断放射性脑坏死没有帮助。氨基酸示踪剂在PET成像中特别有用,因为在肿瘤细胞增殖和细胞外基质产生中氨基酸的利用率很高。此外,正常的脑组织对氨基酸的吸收相对较低,这提供了良好的组织对比。包括碳-11蛋氨酸(MET)、氟-l-胸腺嘧啶(FLT)和氟乙基酪氨酸(FET)在内的示踪剂已被使用,并取得了良好的结果。特别令人感兴趣的是氟乙基酪氨酸FET-PET,其中添加的动态数据分析报告的敏感性为全切,特异性为93%,与某些持共振波谱(MRS)的结果相似。
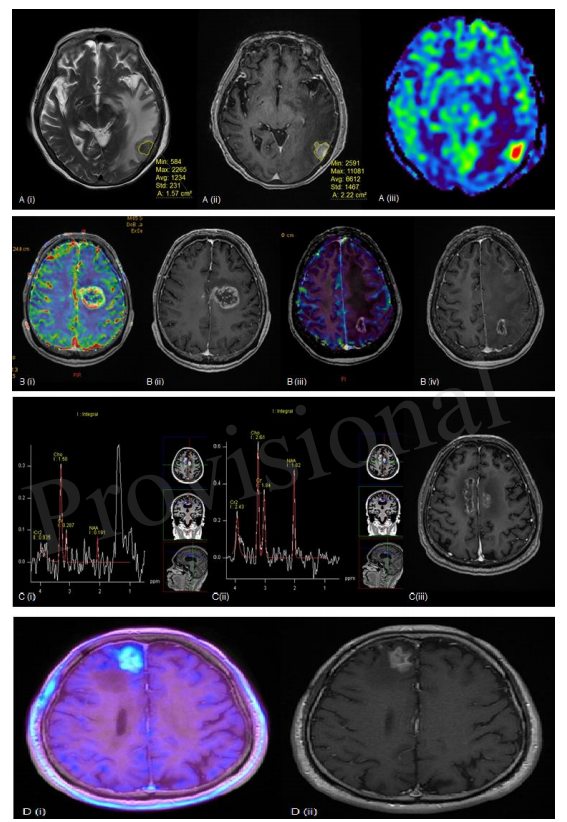
图1展示了几个例子,在这些例子中,上面的方法被用来评估放射性坏死。目前,还没有一种单一的方法可以准确区分肿瘤复发与放射性脑坏死,活检仍被认为是诊断的黄金标准。鉴于每种诊断方法的局限性,可能需要采用多种诊断方法来提高诊断信心。
图1所示。(A)(i)左侧颞叶病变的T2加权(T2W);(ii)对比增强后T1加权(T1W);(iii)相对脑血容量(rCBV)MR灌注序列。利用T2W成像上的低信号结节与T1W成像上的总增强面积之比)计算病灶商数。本病例病灶商数为0.71,rCBV增高提示肿瘤复发。(B)(i)rCBV和(ii)对比增强后T1加权序列显示病灶周围血流量增加。组织病理学证实为肿瘤复发。(iii)rCBV和(iv)另一患者对比增强后T1W序列显示,与放射性脑坏死相一致,病灶周围血流量未增加。(C)(i,ii)MR波谱分析和(iii)全脑放疗后胼胝体周围生长的病变的T1加权序列。(i)右侧扣带回的放射性坏死中典型的高脂质-乳酸峰值,而(ii)显示Cho:Cr比值和Cho:NAA比值升高,提示左侧扣带回肿瘤复发。(D)(i)F-18 FET PET显示在增强的病灶内有强烈的氨基酸示踪剂摄取;(ii)对比增强后T1加权序列,提示肿瘤复发,组织学上发现为复发性肾细胞癌转移。
•病理评估
放射外科治疗后手术切除的病灶的组织病理学表现通常为残留肿瘤细胞和放射性脑坏死混杂。内皮细胞较容易受到辐射损伤,通常表现为纤维样坏死(fibrinoid necrosis)、出血、透明样变性(hyalinization)和血管血栓形成,导致周围组织缺氧损伤。坏死区域通常为多细胞的(paucicellular),周围是高度胶质化的脑组织,由胶质纤维酸性蛋白(GFAP)反应性星形胶质细胞组成,呈现出明显的细胞质分支(ytoplasmic ramification)c。常伴有泡沫状巨噬细胞(Foamy macrophages)和含铁血黄素吞噬细胞(hemosiderophages),偶尔伴有营养障碍性钙化(dystrophic calcification)。此外,可见到放射引起的细胞异型性(radiation-induced cytologic atypia),以巨细胞(cytomegaly)为特征,具有奇异的“泡状”核()bizarre“bubbly”nuclei),维持整体核-细胞质比值低。与之相反,在复发性肿瘤中,肿瘤坏死常表现为肿瘤细胞的鬼状轮廓(ghost-outline),核-细胞质比值高。想象(reminiscing)肿瘤所行径的血行路径,仔细检查血管是很重要的,因为残留的活性肿瘤可能存在于Virchow Robin间隙周围,或者在血管内群集(intravascular clusters)。在疑似肿瘤复发并叠加放射性损伤的情况下,根据已知的原发瘤种,有限的免疫组化组合(panel)可以帮助突显在苏木素-伊红染色切片上可能不明显的存活肿瘤。一个放射性脑坏死患者的组织病理学评估如图2所示。
图2.(A)在使用伽玛刀放射外科(20 Gy,50%等剂量线)治疗后6个月,一名已知的转移性乳腺癌患者的脑肿瘤切除标本。坏死区域表现为细胞减少,与周围的脑胶质细胞有明显分界。几乎没有坏死的透明样变的血管(黄色箭头),以及分散的活性星形胶质细胞(绿色箭头)。总体特征是放射性坏死。(B)常存在泡沫状巨噬细胞。毛细血管扩张充血(ectatic and congested)。(C)在透明样变的背景下,病灶区域显示核多形性细胞增多,残留存活肿瘤的可能性增加。(D)免疫染色(棕色),GATA3标记有许多存活的肿瘤细胞。经核染色突显核多形性更加突出。
放射性脑坏死的处理
放射性脑坏死的处理主要取决于症状的出现。有症状的患者可能会出现头痛、恶心、认知障碍、癫痫,或与病灶位置有关的局部神经功能障碍。
鼻咽癌患者的放射性脑坏死的放射影像学数据表明,三分之一或少于三分之一的患者随时间推移会自发缩小,并不总是一个不可逆的进展过程。因此,对于小的和/或无症状的放射性脑坏死,观察是一个可行的治疗选择。然而,更密切的临床和放射影像学监测是必要的(例如,每隔6-8周,然后当病变稳定/缩小时,延长到每隔12-16周)。Patel等报道,大约三分之一接受放射外科治疗的患者在随访期间病灶会增大,发生在放射外科治疗后6周至15个月之间。与直觉相反,病灶进展的患者比病灶大小稳定或缩小的患者生存时间更长。他们假设放射外科治疗后的病变生长可能是由于活跃的反应性免疫反应造成,而不是肿瘤复发。然而,对此需谨慎解释,因为存在固有的选择偏倚。
对于有症状的患者,口服皮质类固醇激素(如地塞米松)作为一线治疗。皮质类固醇激素可以减少坏死组织产生的炎症信号和细胞因子,减少血脑屏障的渗漏。由于会使脑水肿消退,大多数患者一旦开始使用类固醇激素,病情就会迅速好转。没有研究指导具体类固醇激素使用的剂量。在作者的实践中,更倾向于使用地塞米松(每天4-8毫克),并逐渐减少剂量。遗憾的是,许多患者需要长时间使用类固醇激素,并且会受到类固醇激素毒副作用的影响,如肌肉病变(myopathy)、医源性库欣综合征、胃溃疡等。
由于血管内皮生长因子(VEGF)已被证明是放射性脑坏死的一个关键中介物,因此使用(针对VEGF的人类单克隆抗体)贝伐单抗(bevacizumab)治疗类固醇激素-难治性放射性坏死值得关注。一项涉及71例患者的汇总分析显示,使用贝伐单抗的放射影像学效应率为97%,临床好转率为79%,地塞米松的平均减少量为6mg。FLAIR的信号和增强体积的中位数降低幅度60%。一项小的随机研究使用贝伐单抗治疗放射性脑坏死,并有安慰剂组的交叉。全部14名患者较终都接受了贝伐单抗治疗,全部患者都表现出放射影像学效应。在症状上没有任何差异,但是大多数患者能够减少所使用的地塞米松剂量。因此,贝伐单抗似乎是一种很有前途的药物;然而,需考虑贝伐单抗治疗的持久性和毒副作用,如出血、血栓和受损伤口愈合。
减少灌注的抗凝剂和药物已经在放射性脑坏死中进行试验,但没有常规使用。例如,作者对11名患者口服己酸可可碱(pentoxifylline)和维生素E进行评估,记录了患者随时间的变化的MRI FLAIR值。虽然总体平均脑水肿有进行减少,但有些患者的脑水肿有所增加。
在另一项研究中,对8名患者进行了肝素和华法林的评估,其中略多于一半的患者出现功能有所恢复。然而,抗凝治疗是否需要无限期地持续下去尚不清楚。
高压氧治疗(HBOT)旨在促进灌注和血管生成。在放射性脑坏死中使用HBOT主要局限于没有充分证明其合适性的病例报道。研究人员还研究使用HBOT作为预防措施,并显示出有希望的结果。然而,HBOT价格昂贵,需要专门的设施,并且需要大量的时间,并且需要20到40次的处方治疗。
对于尽管保守治疗仍有症状或诊断尚不确定的患者,可考虑手术切除。手术切除的主要优势是减轻任何占位效应和获得组织学证实。这影响了随后的治疗决定,有助于预后。去除重要坏死组织病灶会带来周围的脑水肿缓解效应,也有助于患者症状好转,并可以戒断类固醇激素。病人的选择仍然是一个重要的考虑因素,包括手术可及性、整体表现状况和预期寿命。早期的报告显示手术切除有很高的并发症率,但这些风险是否在当代仍然存在还有待观察。在坏死组织与存活肿瘤混合的情况下,需要临床判断是否需要进一步治疗。
新的技术,如激光间质内热凝治疗(laser interstitial thermal therapy,LITT)正在成为治疗的选择。LITT是一种图像引导的方法,使用激光纤维产生高温,并促进肿瘤组织或产生VEGF的反应性胶质细胞的消融。一项前瞻性研究显示这个方式是顺利的,并且可让三分之一的患者停止使用类固醇激素治疗。
结论
由于广泛使用放射外科治疗,越来越多地会遇到放射性脑坏死。有症状的放射性脑坏死可导致的并发症发生率,应该予以处理。目前还没有一种单一的方式可以可靠地区分放射性脑坏死和肿瘤复发,通常需多模态的方法来帮助鉴别。对于有症状的放射性脑坏死的患者,口服皮质类固醇激素治疗和贝伐单抗治疗均可合适。少数病人,如果诊断不清楚或症状难治性,需要手术切除。由于放射性脑坏死的诊治充满挑战,在临床决策中风险因素的缓解就变得相当重要。




