低级别胶质瘤(Low-grade glioma,LGG)可侵袭周围脑组织,因此难以治愈。越来越多的研究表明,较大水平地切除肿瘤,肿瘤残留体积达较低,可以延长总体生存期(OS)和无进展生存期(PFS)。美国加利福尼亚大学旧金山分校神经外科的Mitchel S.Berger等回顾性研究肿瘤切除范围与预后的相关性,发现切除范围对不同分子亚型LGG的作用仍然不明确,而且大范围切除所造成的言语、运动和认知功能障碍可以影响OS和生活质量。结果发表在2019年1月《Neurosurg Clin N Am》85–93页上。
截止至1990年,已有30项研究确认扩大肿瘤切除范围可以延长LGG患者的OS和PFS(表1)。依据WHO 2016年胶质瘤分类标准评估,IDH1突变型Ⅱ级星型胶质瘤的中位OS为9-10年;而IDH1突变、1p19q共缺失的少突胶质瘤的中位OS超过14年。WHOⅡ级胶质瘤,不论分子亚型,全切除的患者OS可达61.1-90个月。Claus等报道,切除范围超过80%或残存肿瘤体积小于10mL,具有的治疗效果。现在,偶然发现的LGG,已采用手术切除,认为按术前MRI-T2加权或者FLAIR序列的胶质瘤信号范围作较大水平地切除可以好转LGG的自然病程;甚至切除胶质瘤的边缘区域可以进一步好转预后。
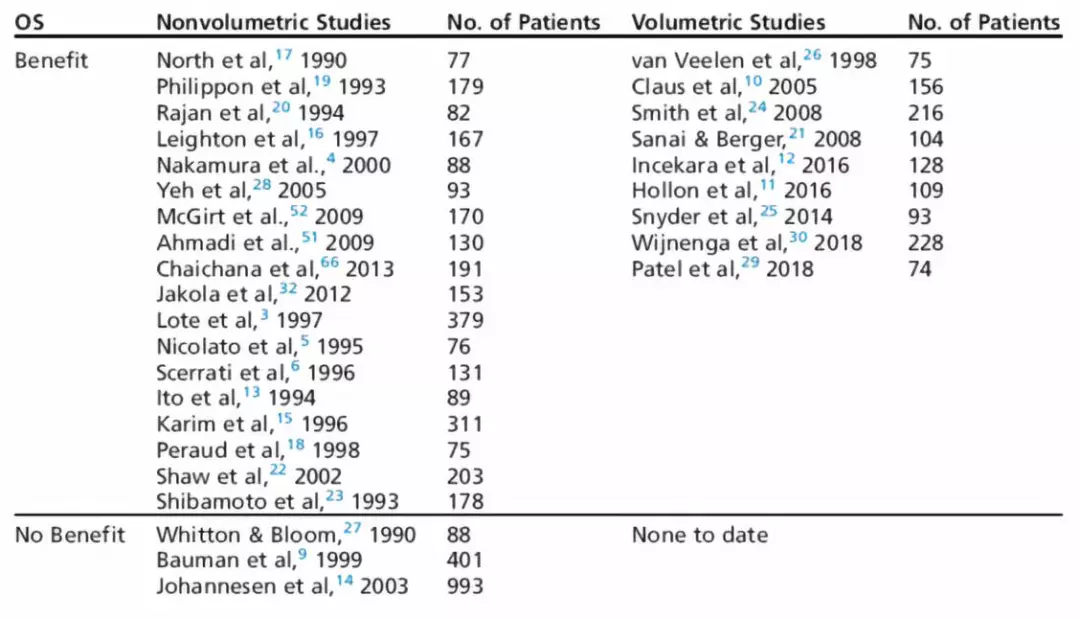
表1.低级别胶质瘤切除程度与预后的文献汇总。
根据WHO较新胶质瘤分子学诊断标准,采用分子标志物分型,可以提高评估患者的治疗反应和预后的准确度(图1)。但相对于预后较差的星形胶质瘤,预后较好的少突胶质瘤是否需要扩大切除范围的问题还是没有解决。由于研究样本数目少,随访时间短,对胶质瘤不同的分子亚型切除程度,尚不能给出确凿的证据。
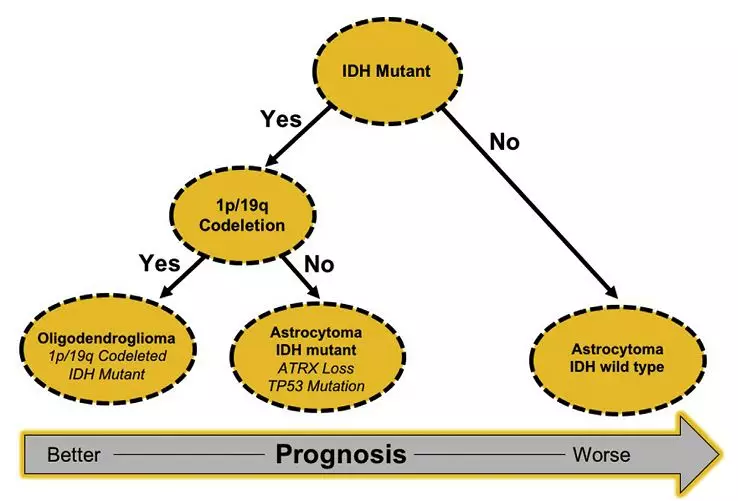
图1.WHOⅡ级胶质瘤的分子学分型。
较后作者认为,确定低级别胶质瘤较大水平切除范围需与神经功能预后一起考量,包括运动、言语功能和非语言的认知功能等;扩大切除范围造成神经功能损伤时对患者的生存将产生负面影响。目前,有学者提出在胶质瘤早期选择保守的、顺利的手术,尽可能保留功能区;而肿瘤复发时,在测量言语和运动功能区范围的基础上,选择作全切除。这种分阶段切除的理念还处于早期实践阶段。应该通过功能MRI、PET和经颅磁刺激等非侵入性间接测量脑功能区定位的大部分数据,结合神经胶质瘤分子分型选择合理的切除范围。当切除范围大于90%时,低级别胶质瘤的10年生存率可达到91%。因为言语、运动和认知功能受皮质联络结构的影响,因此较大切除范围的确定需与针对胶质瘤影响脑神经网络的研究相结合。
Mitchel Berger教授来自美国神经外科医院三、国际闻名的神经外科疾病研究和治疗机构UCSF医学中心,是全美公认的成人及儿童脑肿瘤治疗专家,也是神经外科领域内清醒脑肿瘤切除术、脑功能监测技术方面的专家。目前,Mitchel Berger教授是美国UCSF医学中心SPORE脑肿瘤项目的研究员、美国国家“癌症登月”计划蓝带小组专家。
Mitchel Berger教授来自美国神经外科医院三、国际闻名的神经外科疾病研究和治疗机构UCSF医学中心,是全美公认的成人及儿童脑肿瘤治疗专家,也是神经外科领域内清醒脑肿瘤切除术、脑功能监测技术方面的专家。目前,Mitchel Berger教授是美国UCSF医学中心SPORE脑肿瘤项目的研究员、美国国家“癌症登月”计划蓝带小组专家。




