早在20世纪90年代,哈维·库欣(Harvey Cushing)就将颅咽管瘤称为“较可怕的颅内肿瘤”,因其病情复杂、被发现时肿瘤往往已经生长较大,不同的发病部位致使手术切除难度大,较易复发、经过治疗的患者还需要长期的神经外科和内分泌学随访... ... 时至今日,颅咽管瘤仍然是儿童和成人较难治疗的脑肿瘤之一。
INC国际神经外科顾问团(WANG)的专家成员、小儿神经外科专家James T. Rutka教授在其著述《Oncology of CNS Tumorsy》的“Craniopharyngioma: Current Classification, Management, and Future Directions”章节中详述了颅咽管瘤的起源和特点,强调了对全部颅咽管瘤患者而言,神经外科医生会通过顺利前提下的高切除率外科手术可以合适降低病人的发病率,与此同时,个体化的护理方案是必要的。
‘
颅咽管瘤的起源和胚胎形成
颅咽管瘤是一种起源于口咽粘膜和原始口咽粘膜的上皮残余物的胚胎性肿瘤。口咽的正常发育始于妊娠二个月初,原始的鳞状粘膜内陷形成正中腺垂体和侧牙板束。通过神经垂体和颊咽膜的融合,同时开始形成垂体-咽管。神经垂体起源于间脑和中脑交界处的突起。颊咽膜形成真皮外突、Rathke 囊,投射到神经垂体。这两个结构在妊娠8周时融合,形成管状结构,进一步塌陷为前漏斗。这些结构的胚胎衍生物的残余通常被认为是颅咽管瘤的起源(图30.1)。
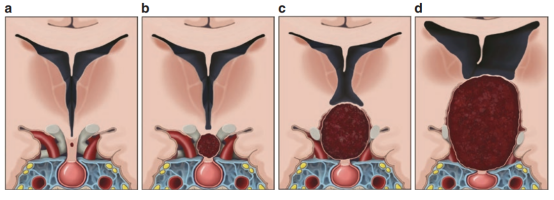
(d) 进行性生长的颅咽管瘤,位于脑冠状切面的侧脑室、三脑室和门室孔。颅咽管瘤起源于口咽粘膜的上皮残余物。这些粘膜成分的残余导致沿下丘脑-咽管形成胚胎衍生物,导致颅咽管瘤的形成(a)。其逐渐生长,首先占据鞍区(b)。但随着进一步扩张,被发现其沿鞍上生长(c),三脑室底部凹陷(d)。
颅咽管瘤的分类
考虑到颅咽管瘤的许多解剖学、放射学或外科特征,其有着不同的分类体系。
- 颅咽管瘤的临床分型多样,主要分为Yasargil分型和Kassam分型。
- 目前中国内主要采用洪涛分型和漆松涛QST分型。
漆松涛QST分型包括鞍膈下型(Q型)、鞍上脑室外型(T型)和脑室底内型(T型)3种类型。
- l为了更好地指导临床医师选择较适宜的术式,根据术前MRI显示的下丘脑受累程度,将颅咽管瘤对下丘脑的压迫分为3级:
1级,颅咽管瘤起源于漏斗部或垂体柄,并向鞍内生长或局限于三脑室,向鞍内生长的肿瘤建议行神经内镜下经蝶窦入路手术,局限于三脑室的肿瘤建议行开颅手术;
2级,颅咽管瘤呈侵袭性生长,下丘脑受压损害而无法清晰辨认,此分级占全部颅咽管瘤的40% ~ 70%,此时开颅手术是理想选择。
此外,内镜技术与显微外科手术联合应用可以观察到开颅手术无法显露的术野,从而实现较大限度地顺利切除肿瘤。上述分型均阐明了肿瘤的发生部位和生长方式,有助于指导手术入路的选择,但迄今尚无任意一种分型可以准确提示肿瘤起源并指导临床咨询。随着内镜技术的发展,神经内镜下颅咽管瘤切除术逐渐受到关注,越来越多的病例选择神经内镜下经蝶窦入路手术而非开颅手术。尽管神经内镜手术创伤小、顺利性高,但采用该术式切除鞍上颅咽管瘤仍存争议,可能加重下丘脑、垂体损伤,也可能导致颅底修复失败,术后一旦发生脑脊液鼻漏,可引起颅内感染、脑积水等并发症,使患者预后不良。颅咽管瘤手术入路的选择更多取决于术者对手术入路的喜好和熟练程度,而与肿瘤分型等因素无明显关联性,因此不同术者对相同患者的术式选择可能存在明显差异。
颅咽管瘤手术治疗困境在哪?
颅咽管瘤起源于颅咽管原始发生通路上的胚胎残留上皮细胞,因此,肿瘤沿颅咽管路径(至灰结节)生长,位置深在且多变,毗邻下丘脑、视神经、垂体柄等重要结构。同时,尽管大部分颅咽管瘤属WHOⅠ级肿瘤、生长缓慢,但仍有少部分肿瘤具有恶性生长特性,呈指状侵袭生长。因此,大多数颅咽管瘤患者临床诊断时即已出现不同程度的下丘脑-垂体功能紊乱、视力视野损害或颅内高压等症状,此时患者一般状况较差,下丘脑-垂体功能储备不足,手术风险较大。此外,术中强调全切除常使肿瘤分离过程中损伤下丘脑、垂体柄等重要结构,术后发生下丘脑-垂体功能紊乱等并发症,从而导致患者预后不良甚至死亡。
关于颅咽管瘤的治疗
1.手术切除
在INC国际神经科学的往期文章《易复发、难手术的良性脑瘤之颅咽管瘤的手术剖析》中,James T. Rutka教授就曾总结道:颅咽管瘤是一个具有挑战性的实体脑瘤,目前主要采用手术和放射治疗。在颅咽管瘤术前考虑中,主要考虑肿瘤的主要位置(交叉前、鞍后、交叉后),以及肿瘤与交叉、下丘脑附着的关系,垂体漏斗和垂体柄的位置,大而复杂的肿瘤可能需要联合不同入路手术。Rutka教授还对不同手术入路进行了深入剖析,并提出了适用于全部方法的四个要点:
2.放射治疗
尽管外科治疗被认为是许多颅咽管瘤治疗的一步,但由于肿瘤全切与神经功能缺损之间的微妙平衡难以掌控,各种无创治疗形式也被广泛运用。放射治疗常用于次全切或肿瘤复发的病例。
虽然目前的策略倾向于较大限度顺利切除后再辅助放疗,但人们对于辐射引起的毒性仍存担忧,包括血管变化、认知缺陷和继发性恶性肿瘤。颅咽管瘤放疗的另外一个问题是颅咽管瘤既有实性部分又有囊性部分,而且二者对放疗的反应可能不同。在治疗期间或治疗后,也存在囊肿增大的潜在风险。虽然囊肿增大通常不需要额外治疗就会消退,但增大的囊肿可能通过影响附近的颅神经或血管结构而引起压迫性症状和体征。
(a)外部放射治疗
目前许多治疗中心的治疗标准是基于光子的调强放射治疗(IMRT),这是一种旨在使周围正常组织免受高剂量辐射的现代技术。利用图像引导技术,对重要的邻近正常结构,特别是耳蜗、脑干、颞叶、垂体、视交叉和视神经进行轮廓化处理,并在保持足够的治疗范围的同时较大限度地保留这些结构。病人用特制的热塑性面罩固定,采用图像引导的方法选择临床目标体积(CTV),包括肿瘤大体体积和术后肿瘤床,外加1cm的边缘。规划目标体积(PTV)包括CTV加上3-5毫米的余量,通常在28个部分接受中值为50.4 Gy的辐射剂量。通过适当的剂量计划,局部疗效可达90%以上。
(b) 内部照射治疗
使用beta发射器的内腔/腔内照射用于治疗颅咽管瘤的囊性成分。用立体定向技术在囊内灌注放射性药剂。病灶对腔内照射的反应,包括囊肿完全溶解或缩小,据报道合适率为71-88%。
(c) 立体定向放射治疗
立体定向放射治疗(SRS)是近年来治疗颅咽管瘤的一种选择,其目的是提高放射治疗的合适性和降低放射治疗的发病率。使用直线加速器(LINAC)或伽玛刀(GK)进行照射。为了使肿瘤与正常邻近组织之间的剂量梯度更大,我们采用了一种立体定向系统来进行靶向定位和治疗规划。对于颅咽管瘤,采用1-5个放射疗程,平均边际剂量为12 Gy。由于肿瘤距离光学仪器较近,光路照射8-10 Gy可耐受,避免视觉损伤。实体瘤的SRS治愈率为90%,囊性瘤为88%,混合性颅咽管瘤为60%。
(d)射波刀放射治疗
射波刀由一个安装在机械臂上的小型轻型直线加速器组成,该机械臂具有6个运动自由度,因此光子束可以亚毫米的精度进行瞄准。使用具有目标跟踪能力的图像引导控制回路,该系统可以根据患者的运动进行调整,并避免使用侵入性帧来稳定患者。在这种方法中,可以将光学仪器在每一疗程中所经历的剂量保持在5Gy以下。据报道,射波刀的肿瘤控制率高达91%。
(e)质子治疗
虽然调强放疗仍是许多中心目前的治疗标准,但质子治疗(PBT)提供的优越剂量谱使其在许多脑肿瘤的治疗中更具优势。质子束放射治疗是利用带正电荷的粒子对周围健康组织进行适形外束治疗的一种不同形式。高能质子以较小的能量损失通过组织,直到到达肿瘤中计算出的较大深度,并在那里释放大部分能量,而辐射不会穿透肿瘤。光路的剂量保持在55个剂量(CGE)以下,对视通路的影响较小。在颅咽管瘤中,质子治疗的存活率和疾病控制程度与调强放疗相当。
3. 化学疗法
由于颅咽管瘤的组织学良性性质,医生很少考虑全身化疗。然而,使用长春新碱、比柔(卡莫司汀)、丙卡嗪和阿霉素的全身化疗疗程已经成功应用于复发性颅咽管瘤,特别是那些有放疗禁忌的患者。如今,博莱霉素和INF-再灌注等化学制剂似乎比全身化疗更受欢迎。临床研究表明,使用INF-α的囊内治疗是一种简单且成本较低的方法,有76%的病例因此实现了肿瘤控制。
4. 基因组学和靶向治疗时代的诊断和管理
虽然传统的治疗方法是手术和放疗,但靶向治疗是一种新的选择,与传统治疗相比,其发病率可能更低。颅咽管瘤的两种组织学亚型是通过不同的分子特征来识别的,因此需要不同形式的靶向治疗。目前认为,釉质表皮型颅咽管瘤与CTNNB1基因外显子3点突变相关。CTNNB1基因突变可使β链蛋白磷酸化和降解受阻,导致细胞核质内β链蛋白沉积,进一步激活WNT/β-连环蛋白(β-catenin)信号转导通路,导致肿瘤发生。CTNNB1基因突变小鼠模型亦证实该基因突变可以导致釉质表皮型颅咽管瘤的发生。釉质表皮型颅咽管瘤发生路径上的分子谱可以显示潜在的治疗相关信号转导通路,有助于小分子控制剂进行靶向治疗。例如,维莫德吉是经美国食品与药品管理局(FDA)批准的SHH信号转导通路控制剂,目前已成功用于髓母细胞瘤和基底细胞癌的临床治疗,研究显示,维莫德吉可能对釉质表皮型颅咽管瘤治疗合适;特异性MEK控制剂曲美替尼通过控制丝裂原激活蛋白激酶(MAPK)信号转导通路,减少釉质表皮型颅咽管瘤细胞数目,降低肿瘤细胞增殖能力并促进细胞凋亡多数釉质表皮型颅咽管瘤患者还存在β-catenin基因突变,激活WNT通路并引起MEK/ERK通路改变,使肿瘤细胞获得更强的增殖侵袭能力,导致釉质表皮型颅咽管瘤的发生,虽然靶向β-catenin基因及其下游MAPK通路的药物尚未进入临床试验阶段,但在体外研究中疗效,有望成为临床治疗的新靶点。
目前仅在乳头型颅咽管瘤中发现BRAF V600E基因突变,尚无其他基因突变或基因组畸变。BRAF蛋白是MAPK信号转导通路的上游调控因子,调节多种生理过程,在肿瘤细胞中表达上调,导致乳头型颅咽管瘤的发生。大多数乳头型颅咽管瘤患者存在BRAF V600E突变并进一步激活下游RAS/Raf/MEK/ERK信号转导通路。研究显示,MAPK通路上表达增多的乳头型颅咽管瘤细胞也高表达磷酸化细胞外信号调节激酶1/2(pERK1/2)和SOX2,表明此类细胞是未分化的前体细胞。约90%增殖的乳头型颅咽管瘤细胞是SOX2+pERK1/2+细胞群,表明MAPK通路上高表达的乳头型颅咽管瘤细胞有较强的增殖能力,但其分化潜能减弱。上述研究提示,正常垂体组织SOX2干细胞可能通过BRAF基因突变而激活MAPK通路,进而转化为乳头型颅咽管瘤细胞,导致肿瘤发生,为BRAF控制剂(如达布非尼和维罗非尼)和MEK控制剂(如曲美替尼和考比替尼)治疗乳头型颅咽管瘤提供了理论依据。不同治疗方法的长期疾病控制效果
肿瘤附着在邻近的结构上以及肿瘤细胞在邻近的脑组织内交错,这一特性导致颅咽管瘤在治疗后会复发。GTR术后肿瘤复发的病例为13-14.1%,而STR或部分切除的肿瘤复发病例为33-64.9%。据报道,GTR术后10年没有复发生存率为74-81%,部分切除后为41-42%,手术和放疗联合治疗后为83-90%。因此,尽管部分切除的生存率较低,但部分切除后辅以放疗可将其提高到与GTR术后生存率大致相等的水平。以调强放疗作为辅助治疗或术后复发治疗选择的患者,10年总生存率(OS)和无进展生存率(PFS)分别为83.8%±8.9%和60.7%±13%。质子治疗术后10年生存率为72%,10年局部控制率为85%。在对接受PBT或调强放疗的患者进行的多机构分析中,两组患者在生存、疾病控制和毒性方面没有发现差异。因此,在部分切除并应用一种放射疗法的情况下,10年局部控制率在70 ~ 全切之间,与GTR相当。
颅咽管瘤患者的标准化总死亡率在2.88和9.28之间。与成人相比,幼儿的预后更差,幼儿与成人的标准化死亡率分别为17和3.5。
后记
INC之James T. Rutka教授在论文中总结道:“颅咽管瘤治疗的结果和并发症一直是由神经外科医生选择的手术入路决定的。对于大的侵袭性颅咽管瘤患者,较好的治疗方法是次全切除,然后辅以放射治疗,而不是试图完全切除,因为邻近结构的损伤可能导致进一步的疾病。”
据报道,颅咽管瘤的总切除率为59-83.5%。内窥镜全切手术的发病率与经颅手术相当,但仍存在脑脊液泄漏并发症的问题。手术切除的程度可能受到组织学亚型的影响。造釉型颅咽管瘤更可能是囊性和钙化的,其表现较大,与邻近神经组织粘连,这些使手术切除更具挑战性。相反,在接受GTR治疗的颅咽管瘤患者中,乳头状亚型界限更清楚,浸润更少,更适合手术全切。在接受GTR治疗的颅咽管瘤患者中,50% - 全切的患者可能会出现垂体功能障碍,高达50%的患者可能出现视力恶化。术后30天内的手术死亡率在1.1 ~ 4.2%之间。颅咽管瘤的治疗方案直接关系到患者的治疗效果和生活质量,主治医师拥有丰富的临床经验和操作技巧,方能更好地为患者“趋利避害”,因此,患者在做出治疗决策时应当更为慎重。
INC旗下国际神经外科顾问团(World Advisory Neurosurgical Group,WANG)是由国际各发达国家神经外科宗师联合组成的教授集团,囊括了神经外科各细分领域的国际教授,包括擅长小儿脑瘤和癫痫治疗的儿童神经外科专家James T. Rutka教授;以技术手法和顺利前提下的高切除率手术而的国际神经外科联合会(WFNS)教育委员会主席巴特朗菲教授等,他们不仅拥有高超的手术技巧和丰富的临床经验,还较为重视患者细节功能的康复,以期提升其生活质量。国内患者可拨打400-029-0925咨询INC海外教授远程视频咨询,与神外教授在线沟通,获取前沿咨询方案。
参考文献:Jörg-Christian Tonn, David A. Reardon, James T. Rutka, Manfred Westphal. Oncology of CNS Tumorsy. 2019




