#2021版中枢神经系统肿瘤分类更新#
2021年6月29日,第五版世界卫生组织(WHO)中枢神经系统(CNS)肿瘤分类(WHO CNS5)最近发布,并刊发在欧洲神经肿瘤协会EANO旗下的神经肿瘤专刊Neuro-Oncology。这是继在2016年WHO中枢神经系统肿瘤更新首次将分子数据与组织学结合起来对中枢神经系统肿瘤进行第二次分类更新。WHO CNS5的变化将肿瘤分为更多生物学和分子定义的病理类型,具有更好的疾病自然史特征,并引入了新的肿瘤类型和亚型,尤其是在儿童人群中。这些更新的分类将使临床医生能够更好地了解特定CNS肿瘤患者的预后和更好治疗,它还将有利于更多同质化的患者群体参与临床试验,促进对新疗法的评估。
在WHO CNS5确立了中枢神经系统肿瘤命名和分级的不同方法;新定义了多种肿瘤类型和相关亚型,包括一些基于DNA甲基化分析等新技术的肿瘤类型;并强调了整合诊断和分层报告的重要性,尤其在儿童及成人群体中中枢神经系统诊疗的有了重大更新,这对后续的临床治疗指导原则有着关键的指导意义。
2021新版脑胶质瘤分类
表:2021年中枢神经系统WHO分类(暂定分类用斜体字标示)

2016版脑胶质瘤WHO分类
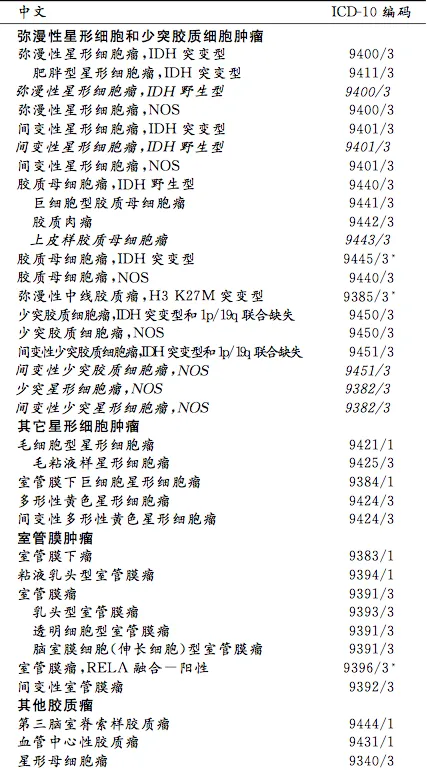
01成人肿瘤分类:
WHO CNS5中最重要的变化主要体现在神经胶质瘤的分类,区分主要发生在成人中的神经胶质瘤和主要发生在儿童中的神经胶质瘤。对于临床医生来说,胶质母细胞瘤分类的变化具有很大的实际意义。以前,胶质母细胞瘤是根据微血管增殖和/或坏死的组织学发现来诊断的,包括IDH突变(10%)和IDH野生型(90%)肿瘤,它们具有非常不同的生物学和预后。在WHO CNS5中,胶质母细胞瘤将仅包含IDH野生型肿瘤。
此外,成人中的IDH野生型弥漫性星形细胞肿瘤没有胶质母细胞瘤的组织学特征,但具有3个遗传参数中的一个或多个(TERT启动子突变、EGFR基因扩增或整个7号染色体的联合获得和整个10号染色体的丢失[+7/−10])也将被归类为胶质母细胞瘤。
在新的分类中,所有IDH突变的弥漫性星形细胞肿瘤都被认为是单一类型(星形细胞瘤,IDH突变),并分为2、3或4。这些肿瘤的分级还将考虑其他分子发现,例如CDKN2A/B纯合缺失的存在导致更差的预后。
即使没有微血管增殖或坏死,具有这些分子改变的IDH突变型星形细胞瘤的WHO CNS等级为4级。虽然将星形细胞瘤分为IDH野生型和突变型肿瘤是一个重要的进步,但它特别强调神经病理学实验室能够获得足够的分子检测并能够及时获得结果,以便识别具有非典型IDH突变的星形细胞瘤的百分比,这些突变不会被IDHR132H免疫组织化学检测到,并且能够识别具有胶质母细胞瘤分子特征的星形细胞瘤。
仅允许在临床试验中研究更同质的人群将胶质母细胞瘤的诊断定为IDH野生型胶质母细胞瘤,然而,IDH突变型星形细胞瘤,尤其是WHO 4级肿瘤,可能仅有较少的试验选择,为这一类患者提供更多临床试验选择也很重要。
02儿童肿瘤分类更新:
02.1儿童胶质瘤:WHO CNS5的儿童临床意义是重大的,将神经胶质瘤分为儿童型和成人型,因为它们具有明确的分子遗传差异。病理亚组分型很重要,但可能具有更大临床重要性的是相关的常见分子遗传变化。儿童低级别胶质瘤诊疗根据分子特征的差异而不同,根据具有特定BRAF突变和融合的肿瘤将患者分开是正在进行的临床试验中公认的原则。
研究发现认识到一些特殊的神经胶质瘤,例如具有复杂组织学特征的毛细胞星形细胞瘤,除了影响预后的BRAF基因改变外,还可能伴随有其他类型突变(如CDKN2A/B、ATRX等)。基于与特征性遗传变化及相关的不同组织学特征,进行儿童型的胶质瘤分类,对于更好地临床诊疗理解至关重要,但对临床医生来说也具有挑战性。每种肿瘤类型可能需要不同的分子靶向方法,因此需要针对相对罕见的肿瘤亚型进行合理的临床试验。
对于儿童高级别胶质瘤,WHO CNS5还建立在2016年分类模式的基础上,该模式确定了有助于定义这些肿瘤的频繁表观遗传变化。识别与神经营养受体酪氨酸激酶(NTRK)家族或其他遗传异常相关的婴儿型半球胶质瘤是该分类的重要组成部分,具有重大的治疗意义。
02.2儿童神经节细胞肿瘤:神经节细胞肿瘤和混合神经胶质神经元肿瘤仍然是需要大量研究,组织学和分子特征的结合对这些肿瘤的分类和理解有了更大的帮助。这和将如何转化为更有效的治疗方法仍有待观察,但越来越多地使用分子靶向疗法无疑已经改变了儿童对此类肿瘤的诊疗方法。
02.3儿童室管膜瘤:基于组织学和分子特征以及解剖部位的室管膜肿瘤分类的修改具有重要意义。对于后颅窝肿瘤尤其如此,因为特定的分子改变(如染色体6q缺失)具有不同的预测价值,具体取决于存在突变的后颅窝室管膜瘤亚型。改良的室管膜肿瘤亚型将如何影响治疗方法尚不清楚,包括某些亚组是否可以用较不激进的手术、放疗或化疗进行治疗。
02.4儿童髓母细胞瘤:关于髓母细胞瘤,WHO CNS5建立在2016年WHO髓母细胞瘤分类的基础上,融合了髓母细胞瘤的临床和生物学异质性。2016版接受了第3组和第4组髓母细胞瘤之间的重叠,并且常见的髓母细胞瘤类型仍然是非WNT/非SHH类别。SHH亚组的肿瘤仍然分为TP53野生型和TP53突变型亚组,并证实了这两个SHH相关肿瘤亚组的不同预后。髓母细胞瘤的分层报告结合了分子信息,仍然是分类的重要组成部分,并且是更好地区分鉴别这些肿瘤的必要条件;现在确定了13个或更多的亚组。然而,它增加了基于分子的临床研究的挑战。如何更好地将单个亚组聚集在一起进行基于生物的治疗仍然是一项正在进行具有挑战的工作。
02.5儿童胚胎性肿瘤:非髓母细胞瘤胚胎性肿瘤仍然存在巨大的治疗挑战。对于非髓母细胞瘤胚胎性肿瘤,除非典型畸胎瘤/横纹肌瘤外,目前临床仍然存在许多问题需要进一步探究,包括手术对生存预后的影响、是否需要局灶性或全脑脊髓放疗、化疗的效用以及有效的分子靶向治疗。很明显,病理、分子基因水平层面的细致具体化,是开发更好的治疗方法方面取得重大进展的保障。髓母细胞瘤和其他胚胎肿瘤共有的一个问题是它们相对常见的潜在种系异常。目前的分类没有考虑发生在这类患者亚群中的癌症易感综合征及可能影响对治疗和结果的反应的种系畸变。
显然,包括WHO CNS5在内的任何分类系统都必须被视为不断更新、不断进行中的工作,更新是对现有的诊疗条件和认识的巨大的机遇和挑战,需要在利用分类指导分子靶向治疗与添加基于不完整生物学理解的无效分子靶向治疗的潜在不利影响之间找到正确的平衡。毫无疑问,未来关于癌症通路激活、脑肿瘤及其微环境的免疫学方面的研究,以及如前所述,这些肿瘤的潜在遗传倾向,将改变脑瘤诊断“定性”“分层”分类。
参考文献:
1.The 2021 WHO Classification of Tumors of the Central Nervous System:clinial implications.Neuro-oncology.2021.
2.Pediatric low-grade gliomas:next biologically driven steps.Neuro Oncol.2018.
3.Anaplastic astrocytoma with piloid features,a novel molecular class of IDH wildtype glioma with recurrent MAPK pathway,CDKN2A/B and ATRX alterations.Acta Neuropathol.2018.
4.Clinical impact of combined epigenetic and molecular analysis of pediatric low-grade gliomas.Neuro Oncol.2020.
5.Ultra high-risk PFA ependymoma is characterized by loss of chromosome 6q[.Neuro Oncol.2021
6.Medulloblastomics revisited:biological and clinical insights from thousands of patients.Nat Rev Cancer.2020.




